权衡利弊:没有定量LC-MS是否存在蛋白质组学生命?

在蛋白质组学的最早期,人们对质谱技术能为生物学和整个科学界所做的事情有极大的兴奋和热情。最初的出版物主要关注已识别蛋白质的“数量”,很少关注在特定的实验条件下确定蛋白质数量的变化,例如,药物干扰或生长因子刺激。然而,一种能够同时分离和定量许多蛋白质的技术是二维凝胶电泳(2DE)。1.在这里,定量是通过比较分析两个或多个凝胶之间的蛋白质染色来实现的,这些凝胶代表了来自不同状态/处理的细胞。随后,用质谱法鉴定了感兴趣的凝胶斑点中的蛋白质。2DE的缺点是,该技术对丰富的蛋白质具有高选择性,对低丰度调控蛋白(如激酶和转录因子)的检测有限2.
在最初对蛋白质组学可能性的兴奋过去后,许多生物学家和质谱学家都后退了一步,进行了反思。如果不仅正确识别样本中的蛋白质,而且还添加定量成分,会更有意义吗每一个而且每一个被鉴定的蛋白质?的确,对这种模式的质疑、出现和最终接受受到了社会的欢迎;随着纳米高效液相色谱(nano-HPLC)与纳米电喷雾电离串联质谱(nanoESI-MS/MS)的成功耦合,开启了定量液相色谱质谱(LC-MS)时代。当被问及他认为为什么这一科学领域对研究人员来说是广泛重要和关键的,Michael J. McCoss华盛顿大学基因组科学教授回答说,“这是一个广泛应用的领域,从测量滥用药物、药理学、蛋白质组学、代谢组学、环境污染物、新生儿筛查、维生素D、法医学,等。“如此显著的应用多样性确保了的定量LC-MS的技术发展和广泛接受已成为科学家日常研究不可或缺的一部分。特别是对于蛋白质组学的应用,Bernhard Kuster教授,慕尼黑工业大学蛋白质组学和生物分析学主席指出,”定量测量在蛋白质组学中很重要,因为这有助于客观地分析(生物)系统。”
我如何量化我的蛋白质?
定量LC-MS技术主要分为两类:(i)相对定量;(ii)通过校准合成的稳定同位素标记标准来确定肽丰度(图1)。目前,大多数科学界在研究问题上采用前一种方法。然而,后者正开始发挥越来越重要的作用;特别是在临床应用中。
LC-MS基于发现的相对定量使研究人员能够同时确定多个样品中蛋白质丰度的变化。 正如Bernhard Kuster所说,“LC-MS特别强大,因为它可以同时定量很多蛋白质,而且不需要知道先天的我们可能想分析哪些蛋白质 ”。 为了真正掌握单个蛋白质的功能以及蛋白质与其他蛋白质在复杂生物系统中的关系,必须测量蛋白质丰度相对于基线或标准系统的变化。顾名思义,相对定量包括在特定条件下比较蛋白质的数量,即。,在条件B, C, D中有多少肽(通过推断,还有蛋白质)等。与a条件下相同肽的数量相比,Kuster还指出,“ LC-MS的强大之处在于,可以对不存在抗体或质量较差的蛋白质进行定量分析”。
从更广泛的意义上讲,LC-MS对蛋白质的相对定量基本上有两种方法。这些是:(i)标记;以及(ii)无标签。前一类可细分为蛋白质组中标记多肽/蛋白质的两种方法。也就是说,通过代谢标记最初是在1999年首创的3.后来被研究界以SILAC的形式广泛采用(年代表格我sotopel亚伯与一个米诺酸c魔法文化)4.蛋白质也可以通过化学衍生化来修饰,这些方法已经包括在内我sotope -c欧迪一个ffinitytags (ICAT)5,18O标记6二甲基标记7等压质量标签,即。,tandem米屁股tag (TMT)和我sobarictag)为r从格和一个大堡问uantitation (iTRAQ)8、9.
使用SILAC,生物样品被标记在体外用目标氨基酸的重同位素版本。在蛋白质合成过程中,天然存在的氨基酸被较重的标记版本所取代。细胞暴露在不同的实验条件下(在轻、中或重培养基中培养),然后可以混合,并在组合样品上执行所有处理步骤(图1,代谢标记)。这种策略显著减少了样品制备过程中可能发生的任何变异性,并具有更准确定量的明显优势。与如。, TMT试剂8,可实现高通量多路蛋白定量。目前,当LC-MS和蛋白质组学数据软件相结合时,可以同时分析多达16个来自细胞、组织或生物体液的不同样品,识别肽/蛋白质,并计算肽/蛋白质的相对数量(图1,化学标记)。
LC-MS的无标签定量最近又重新流行起来。来自社区的这种新的兴趣主要是由于当前质谱仪的质量分辨率的提高,新的HPLC系统的保留时间稳定性的提高,以及改进的数据分析算法,不仅对准多个色谱迹;但也可以从痕迹中提取出许多特征。与此同时,数据独立采集(DIA)也已成为整个蛋白质组深度、无标签相对蛋白质定量的强大方法。总的来说,无标签定量方法是一种非常经济有效的替代SILAC和TMT的方法,其主要优势是在不使用任何同位素标签的情况下比较多个样品中蛋白质丰度的变化。样品采用LC-MS单独分析;在分析由数百甚至数千个患者样本组成的队列时,这是一个非常有利的方面。通过复杂的软件算法,现在可以更直接地在整个LC时间尺度上集成与独特肽离子对应的信号。lc - ms采集数据后,可以对单个分析进行比较,并对所有样品共同的色谱特征进行比对(图1,无标签)。通过无标签LC-MS进行蛋白质组定量的主要优点是能够比较无限数量的样品,并且可以淘汰昂贵的标记策略。 A major disadvantage, however, is that there is increased LC-MS acquisition time (as each sample is run consecutively). Nevertheless, new systems are appearing on the market than can provide very rapid and short LC gradients to diminish the time required to analyze thousands of clinical samples.
使用稳定同位素合成的多肽作为LC-MS定量蛋白质的内部标准的概念是由德西德里奥和凯10 (图1,附加标准)。这些是合成的胰蛋白酶肽,具有与自然产生的感兴趣的肽相同的氨基酸序列。然而,所合成的多肽含有至少一种稳定的同位素标记氨基酸,导致分子质量略有增加(6-10 Da)。将“已知”量的合成肽等量添加到蛋白质组学文摘中,并通过LC-MS分析整个样品。天然肽和加标肽将在质谱仪中进行色谱共洗脱和电离。的m / z然而,这两种肽是很容易区分的。从提取的离子色谱图和两种肽的曲线下面积的计算,可以通过比较峰值比来估计天然肽的数量。普遍接受的建议是每个蛋白质至少合成三个胰蛋白酶肽。如果每次实验需要定量几种蛋白质;然而,价格很快就上涨了。此外,虽然肽标准的峰值是一个相当直接的方法,校准肽丰度以反映蛋白质水平仍然是一个挑战11.已经提出了解决这些困难的替代校准方法,包括:如。,使用单点公共参考池12、13.
为什么我要量化我的蛋白质?
肽和蛋白质定量是理解蛋白质动态的核心,特别是在活跃和动态蛋白质组的不断变化的通量中,是蛋白质组学领域许多关键意见领袖研究的基础。Bernhard工业 例行公事地 使用定量LC-MS来进一步研究。“我们的目标是 更好地理解抗癌药物如何在细胞和肿瘤中起作用。为了捕捉这些生物系统的分子复杂性,我们需要能够在一次实验中以高通量定量测量许多蛋白质的技术。在这种情况下,我们所有的研究都从这种生物系统的LC-MS开始,以便建立可以后续进行更专业实验的假设。”同样,Mike McCoss也附和了Kuster的话,他说 我的实验室。是LC-MS实验室。我们所做的一切都围绕着LC-MS进行定量测量。我们肯定没有发明它,但我们对它做出了贡献,我们经常将它应用到许多不同的应用中。”
当被其他科学家问及定量LC-MS技术的认知水平时, McCoss回答说,“我很确定所有的化学家,生物化学家和细胞生物学家,等。非常熟悉定量LC-MS,大多数人可能在某个时间点受益或依赖它。”Kuster同意地回答说:“在生命科学界,LC-MS作为一种定量方法是非常有名的;然而,LC-MS作为一个整体仍然没有像基因组技术那样经常使用。这是因为科学家们还没有那么容易/广泛地使用这项技术。”
定量LC-MS是现代蛋白质组学的基础
定量LC-MS技术已经成为蛋白质组学实验中不可或缺的重要组成部分。事实上,定量测量是当今几乎每一项蛋白质组学研究的核心。这是由LC-MS和相关样品制备、分离和数据分析方法的发展所推动的,LC-MS现在是最先进的事实上的蛋白质组学定量测量标准。对于McCoss团队来说,这是不言而喻的。” 我们主要是一个蛋白质组学实验室,对开发和应用质谱技术进行蛋白质定量分析有着浓厚的兴趣。”库斯特实验室运行着一个相当大的LC-MS平台,由七个系统组成,每周7天,每天24小时运行。因此,正如Kuster所言,“技术是我们日常工作的核心”。此外,“技术继续快速发展(伴随的信息学也是如此)。因此,LC-MS的前景非常光明。需要发生的是,基础生命科学家和临床医生更容易使用这项技术,以便对人类产生更大的影响,如。比如医疗行业。”
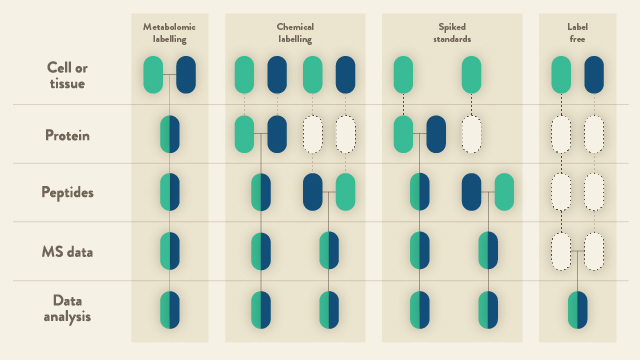
图1:基于定量LC-MS的蛋白质组学工作流程。蓝色和绿色方框代表两种实验条件。水平线表示样本组合的位置。虚线表示实验变化和定量误差可能发生的地方。改编自14.
参考文献
1.
p·h·奥法雷尔,J。医学杂志。化学。250, 4007-4021(1975)。
2.
s.p.吉吉et al。,摩尔。细胞。医学杂志。19, 1720-1730(1999)。
3.
y Odaet al。,Proc。国家的。学会科学。美国96, 6591-6596(1999)。
4.
王淑娥et al。,摩尔。细胞。蛋白质组学1, 376-386(2002)。
5.
s.p.吉吉et al。,Nat.Biotechnol。17, 994-999(1999)。
6.
x么et al。,分析的.化学。73, 2836-2842(2001)。
7.
徐俊良et al。,分析的.化学。75, 6843-6852(2003)。
8.
a·汤普森et al。,分析的化学。75, 1895-1904(2003)。
9.
P. L.罗斯et al。,摩尔。细胞。蛋白质组学3., 1154-1169(2004)。
10.
d·m·德西德里奥和m·凯,生物医学。质量范围。10, 471-479(1983)。
11.
c·m·舒福德et al。,分析的化学。89, 7406-7415(2017)。
12.
r·p·格兰特和a·n·霍夫纳格尔,中国。化学。60, 941-944(2014)。
13.
L. K.皮诺et al。,分析的化学。90, 13112-13117(2018)。
14.
m . Bantscheffet al。,分析的Bioanal。化学。404, 939-965(2012)。


