如何选择正确的Western Blot检测方法

Western blotting是一种以蛋白质大小为基础的分离和检测为核心的分子生物学技术。它包括十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),然后将蛋白质转移到膜上(硝化纤维或聚偏二氟乙烯- PVDF),随后用一抗体和二抗体检测蛋白质。可以找到详细的western blotting协议在这里.
重要的是要了解在膜上检测感兴趣的蛋白质的不同方法的优点和缺点。在这里,我们介绍三种主要类型的蛋白质检测western blot: 1)放射性,2)酶,和3)荧光图1。
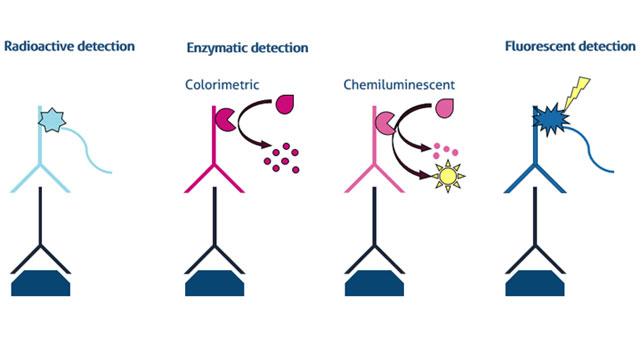
1.放射性检测
最初的一抗检测方法之一是使用标记的二抗放射性同位素(PMID: 388439)。碘-125是一种受欢迎的选择,它的半衰期相对较长,发射的伽玛射线由低能光子组成,可以很容易地用x射线薄膜检测到。它曾经是一种流行的技术,如今却很少有人使用。
优势放射性检测具有良好的灵敏度和可量化性。
缺点:
•相当费力——二级抗体通常必须由最终用户用放射性同位素标记。
•相当昂贵。
•危险-需要专门的辐射安全培训,适当的个人防护装备(PPE),登记和废物处理系统。
•由于标签的放射性衰变,检测抗体的保质期有限。
建议:不使用,更现代的方法更有效-见下文。
2.酶的检测
western blot中最常见的检测方法之一是使用与酶偶联的二抗。二抗对一抗识别的靶蛋白具有结合特异性,而附着的酶用于检测。在膜与二抗孵育之后,将含有特定底物的溶液应用于膜上。酶催化底物的转化,底物严格定位于膜上二抗体结合的位置。该反应的结果是在膜上形成一种不溶性的彩色沉淀物或释放出可以检测和量化的光子。这分别是比色法和化学发光检测的基础。
一个。比色
比色检测中最常用的两种酶是碱性磷酸酶(AP)和辣根过氧化物酶(HRP)。在western blot膜与AP或HRP偶联的二抗孵育后,膜与含有酶底物的溶液孵育。在AP的情况下,底物是被还原为不溶性甲醛的四唑盐。HRP的显色底物包括二氨基联苯胺(DAB)、四甲基联苯胺(TMB)和偶氮-乙基苯并噻唑-磺酸(ABTS)盐。酶促反应在western blot膜上的显色产物是肉眼可见的,并且大部分时间稳定。沉淀物的数量可以量化,并与所分析的蛋白质的数量相对应。
优势:
•便宜又快捷。
•生成的彩色产品是稳定的(几小时到几天),因此即使在印迹后数周也能成像和量化。
缺点:
•难以量化-由用户定义沉淀反应的持续时间,在大多数情况下是不可逆的。测定的线性范围有限。
•灵敏度-通常需要至少纳克的分析蛋白的存在,以创建可见的条带,这是劣于化学发光和荧光检测方法。
建议:用于抗体筛选和快速评估。
b。化学发光
HRP和AP酶也可用于适当底物的化学发光检测。与AP相比,HRP更常用,因为使用鲁米诺或吖啶酮基化合物可获得更广泛的底物阵列和更高的灵敏度。与比色检测类似,western blot膜与酶偶联的二抗孵育,然后将含有适当底物的溶液涂在膜上。反应的中间产物产生低能光子,可以通过将薄膜放在x射线胶片上进行检测,也可以通过电荷耦合器件(CCD)相机进行数字收集。与比色检测不同,产品不是不溶的,不会在膜上形成可见的沉淀物。反应是短暂的,需要在最初的几分钟到几小时内进行检测。市售HRP基板具有很高的灵敏度。
优势:
•灵敏度-分析蛋白的飞图可以检测和定量使用特定的HRP底物。
•定量-数码相机的使用允许识别过度曝光的膜,以确保在检测的线性范围内进行测量。
缺点:
•检测的时间-光只在衬底转化为产品的过程中发射-检测需要在添加衬底后立即执行。
•缺乏多路复用-如果两个被检测的蛋白质大小相似,化学发光检测不可能同时检测两个蛋白质。需要连续检测-在与针对第二目标蛋白的抗体孵育之前,需要从膜上剥离第一个检测抗体。膜剥离需要额外的时间和控制,以确保膜上没有蛋白质损失。
建议:理想的定量和当需要高灵敏度时,由于样品中的分析蛋白水平低。
3.荧光检测
在这种方法中,检测抗体不与酶偶联,而是与荧光团偶联。荧光团被特定能量的光激发,这导致发射较长波长的光(例如;激发为680 nm,发射为694 nm)。用二抗孵育后的western blot膜用装有雪崩光电二极管(APD)或CCD相机的设备成像,该设备可检测发射光。不像酶的检测,不需要底物来实现检测。使用的荧光团通常在光谱的极右端(红色和红外),以尽量减少自发荧光。检测需要使用专用的设备,能够用选定光谱的光照亮膜。光源主要是led或激光。过滤器集允许特定的荧光团检测和最小化背景。使用具有非重叠发射光谱的多个荧光团可以同时检测多个检测抗体,而无需清洗和重新探测膜。
优势:
•多路复用——允许同时检测两个分子量非常相似的蛋白质,当检测抗体对与不同的荧光团偶联时。当比较磷酸化蛋白的丰度与总蛋白水平时,这是特别有用的。
•稳定性-与检测抗体孵育后,膜可在室温下储存数月,并在方便的时间检测信号。
•使用简单-在检测前与二抗孵育膜后不需要额外的步骤。
缺点:
•需要专用设备进行检测和图像采集。由于标准PVDF膜的自然自发荧光,需要使用特殊的PVDF膜。
•灵敏度-比化学发光检测低,但线性范围宽。
建议:理想的量化和多路复用。
所有提出的检测方法都有优点,但也有局限性。为了达到最佳效果,优化western blot协议和实验条件是很重要的。良好的效果需要良好的信噪比,这通常可以通过最小化背景或改善弱/无信号、非特定波段来实现。


