故障诊断新基因治疗的发展

基因治疗超过治疗遗传疾病,它可以治愈他们。一次性剂量non-replicative病毒载体,如常用的重组腺相关病毒(AAV),提供了一个功能基因替代或补偿功能失调的版本导致病人的疾病(图1)。作为一个尖端的生物制药技术,有多个基因疗法现在FDA批准;有数百人在临床试验中,我们可能会看到更多的治疗方法很快在市场上。1然而,为了跟上快速的临床研究中,开发人员正在努力制造和质量控制过程进行简化,以提高质量和降低成本的这些重要的药物市场。
开发人员使用多种分析测试发展基因疗法和优化他们的生产过程。当开发人员得到异常的测试结果,他们必须能够解释问题所在。生产过程产生的不良产品,或分析检测方法不可靠吗?分析测试公司的基础设施、人员和经验通常与开发商合作,加强分析可变性,以便测试结果标明有机会提高效率和产品质量。
1590077756898.jpg)
图1所示。重组病毒载体基因传递。含有治疗基因在基因治疗中,病毒衣壳是由病人的细胞和细胞核的遗传物质传递。,所需的蛋白质基因被表示为一个病人的健康。来源:Avomeen。
衣壳的并发症
主要制造的挑战,开发人员面对杂质来自AAV载体本身(图2)。例如,空AAV衣壳代表期间必须最小化的关键杂质净化的基因治疗产品。这些完整的病毒衣壳不包含DNA。当他们管理一个病人,他们有可能导致危及生命的不良事件,如免疫毒性任何潜在的治疗中获益。同样适用于衣壳含有部分治疗性基因的副本,这可能是由于不完整的病毒包装生产过程。此外,空衣壳或衣壳部分包装可以与完整的衣壳感染病人的细胞。数量不活跃的衣壳的剂量越大,总剂量越高一个病人需要治疗的效果。剂量越高,风险越高的严重不良事件。
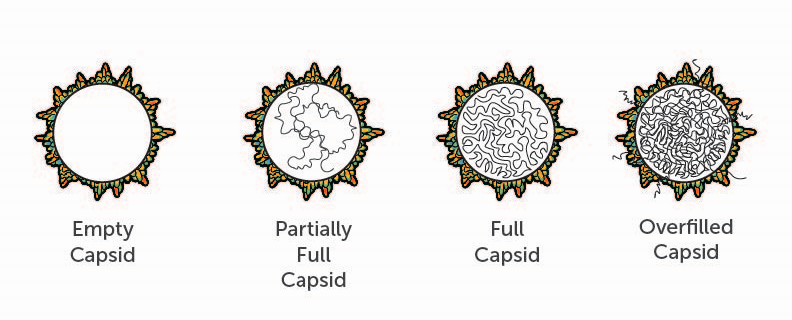
这些杂质如何产生?每个重组AAV衣壳是为了实现单链DNA编码基因治疗。AAV粒子组装从60衣壳蛋白,确定化学计量和形状。2然而,可能有一个高度的波动率的三个AAV衣壳构件,变量转录后修饰。这种复杂性增加的可能性形成缺陷病毒颗粒,无法提供所需的基因治疗。在分子水平上,这些杂质相似所需的,活跃的产品。开发者必须最小化的一代和其他不受欢迎的产品在生物处理上游制造业、和/或减少或删除它们从最终AAV下游过程中产品。
有几种方法可以测量空/满衣壳比率,以及开发人员建立他们的化学、制造和控制(CMC)协议,重要的是,他们选择一个优化的方法,因为他们必须使用有效的质量控制方法的早期过程开发很多释放和稳定。3基因疗法的开发人员可能会选择分析超速离心法对衣壳,尽管非常有效,但该方法定量,健壮的或有效的一些新方法。高效液相色谱法(HPLC)使用AAV完整/空分析列已经被证明是非常有效的分离,空的,健壮的量化和不当衣壳。此外,这个方法比超速离心法更高的吞吐量,并需要更少的珍贵AAV示例运行。
确定产品的分子指纹
病毒衣壳蛋白需要由正确的蛋白质 序列,他们往往需要充分活跃在特定翻译后组细胞。这些品质的基因疗法,和相关杂质,具有在过程开发和质量控制通过肽图的过程。
肽映射是通过液相色谱加上串联质谱(质/ MS)。它映射出主AAV粒子所必需的蛋白质序列和转录后修饰在细胞的功能。地图可以用于身份测试监控衣壳生产的任何变化或杂质水平与生产战略的变化。这样,在优化过程和扩大生产规模,开发人员可以确保AAV将始终有效管理病人。
评估效能和杂质
最后,必须分析其基因治疗转导细胞,检测细胞毒性杂质的能力。这些测试的功能读出基因疗法,揭示如果治疗基因传递功能在活细胞中。
细胞效能评估通过转导细胞AAV产品然后测量“表型”或由于转导功能结果。发展这些测试可能是一个挑战,因为没有放之四海而皆准的测试会给开发人员所需的答案。开发人员经常利用分析实验室的经验来确定如何最好地评估他们的AAV产品的转导效率。
基因治疗的发展也必须被测试,以确保它是免费的残余,流程相关杂质等 表面、iodixanol泊咯沙姆和其他辅料,必须删除在最后的产品,以确保安全。很少有研究和生产设施设备和专业知识需要执行这种测试,和找到一个有经验的测试是明智的聚合物,可推断出的可滤取的检查,如果组件制造设备或药物的包装不污染最终产品。
降低成本提高可访问性
基因疗法相比其他药物是出了名的贵。4然而,一次性治愈的成本更接近一个终生治疗比人们想象的。5开发商大,前期投资在药物研究、开发和制造,涓涓的病人,但实验室,专门从事分析测试的目标是简化流程,减少所有人的负担。
基因治疗是一个新兴领域,有一个未满足的需求为准则,以提高效率的基因疗法CMC测试。然而,到底是标准化流程更好的强度比较,力量,和particle-to-infectivity比例向量的实验室和研究,最终建立一个共同的剂量单位。而 两个AAV血清型参考标准可用来支持这项工作,有一个叫开发更健壮的分析化验,确保一致性质量控制在基因治疗的发展和随后的释放给病人。6
此外,因为新奇的技术,行业标准分析评估质量的基因疗法是不断变化的。早在2020年1月,FDA对于开发人员发布了七个新的指引。7值得注意的是,这些被视为一种最低要求的早期基因疗法的球员,谁,因为他们开发新的疗法,是推动自己达到一个更高的质量标准和分享重要发现塑造未来的行业标准。
基因治疗领域一样快节奏的现在,它成为一个真正的比赛的终点线为市场带来新的基因疗法在不久的将来。监管机构正变得越来越熟悉审查基因疗法,和商业化的道路将更加迅速。无可否认,基因治疗会给患者带来难以置信的好处,但这将是提高生产效率和降低成本的关键基因疗法的病人需要他们更容易。
引用
1。Colasante, W。,柴油,P。,Gerlovin列弗。(2018)。新方法对基因和细胞疗法的市场准入和报销。细胞与基因。检索:https://www.cellandgene.com/doc/new -方法-市场-访问和报销- -基因和细胞治疗- 0001
2。j·弗雷泽•莱特(2014)。产品相关杂质Clinical-Grade重组AAV载体:特征和风险评估。共同参与,2、80 - 97;doi: 10.3390 / biomedicines2010080
3所示。美国食品和药物管理局(2019)。指导人类体细胞治疗和基因治疗。检索:https://www.fda.gov/animal-veterinary/guidance-industry/chemistry-manufacturing-and-controls-cmc-guidances-industry-gfis
4所示。Stein r (2019)。为210万美元,新的基因疗法是有史以来最昂贵的药物。美国国家公共电台。检索:https://www.npr.org/sections/health - shots/2019/05/24/725404168/at - 2 - 1.25亿-新-基因疗法- -最昂贵的药物
5。科恩,J。T,钱伯斯,j . D。、银、m . C。林,P。诺伊曼,P.J. (2019)。把新基因疗法的成本和效益。卫生事务。检索:https://www.healthaffairs.org/do/10.1377/hblog20190827.553404/full/
6。写明ATCC写明ATCC病毒(2020年5月访问)参考资料。检索:https://www.atcc.org/en/Standards/Standards_Programs/ATCC_Virus_Reference_Materials.aspx
7所示。美国食品及药物管理局(2020)。FDA基因疗法在七个指引政策细节。检索:https://www.fdanews.com/articles/195767-fda-details-policies-on-gene-therapies-in-seven-guidances

