肿瘤血管生成
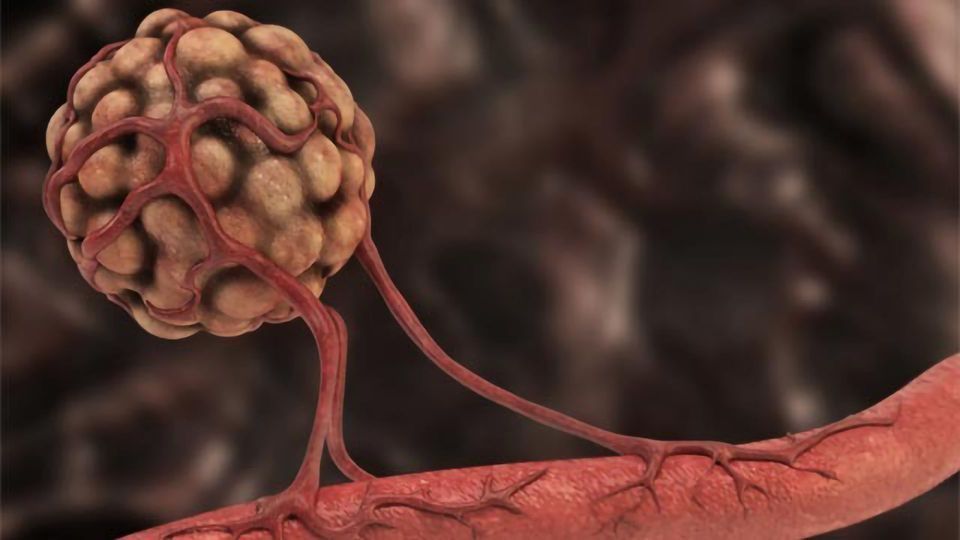
血管新生在癌细胞生长和肿瘤转移中起着关键作用,被认为是一个有吸引力的靶点而且这是癌症治疗的重大挑战。
在这篇文章中,我们将着眼于血管生成与癌症之间的关系,强调p38α在血管生成调节中的作用,探索非血管生成肿瘤的存在,并讨论治疗靶向血管生成的方法。
“血管生成是一个过程,其特征是从现有的血管系统中形成新的毛细血管,这对正常胚胎发育和组织修复至关重要。然而,血管生成也已成为炎症性疾病、肿瘤进展和转移的关键因素。天使Nebreda巴塞罗纳研究所信号与细胞周期实验室组长。
形成新血管
一旦肿瘤生长超过几毫米大小,它就可以启动“血管生成程序”,从而直接或间接地影响它所接受的血液供应。肿瘤形成新血管的能力保证了其氧气和营养的供应——这是癌细胞生长、侵入局部组织和转移到体内远处部位(转移)的基本资源。
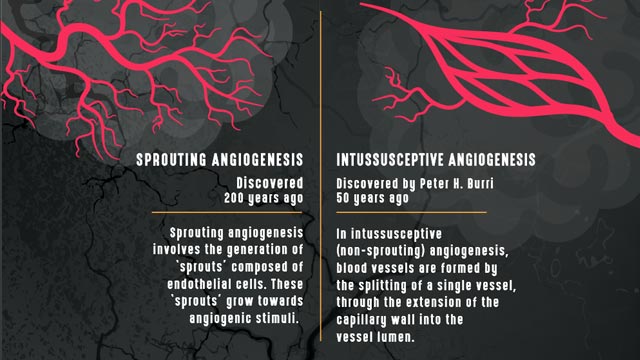
发芽vs肠套叠血管生成。资料来源:科技网188金宝搏备用络。
“在人类肿瘤中最常见的血管生成类型被称为“新生血管生成”,在这种血管生成中,新血管从已有的血管中萌芽,就像缺氧发生后树上形成的新分支一样,”解释说弗朗西斯科·Pezzella约翰·拉德克里夫医院医学系肿瘤病理学教授。Pezzella的研究主要集中在肿瘤血管生成、缺氧和细胞周期。
Pezzella解释说,导致血管生成的最常见的一系列事件是那些涉及血管生成缺氧诱导因子(HIF)和血管内皮生长因子(VEGF)通路.
随着肿瘤组织氧张力的降低,HIF-1[缺氧诱导因子-1]变得“稳定”,并在癌细胞核内积累。在这里,它诱导大量缺氧反应元件的转录。其中包括VEGF-A,血管生成蛋白主要参与这一过程,”Pezzella继续说。
Pezzella解释说,在高水平VEGF-A存在的情况下,当内皮细胞松开连接并开始从底层基底膜分离时,原有的血管可能会“渗漏”。
“当一些内皮细胞完全分离时,它们开始沿着VEGF-A分子的梯度向血管生成信号的来源迁移。与此同时,内皮细胞分泌血管生成素-2,与血管生成素-1竞争,消除后者的抑制作用,”Pezzella说。
这一过程导致内皮细胞开始增殖,沿着促血管生成因子的梯度形成新形成的细胞束。Pezzella解释说:“随着新形成的血管变长,腔体形成,含氧血液进入,随着缺氧的消除,血管生成因子的分泌停止,新血管恢复静止状态。”
“内皮细胞停止分裂,只有最先进的细胞继续增殖。最终,新血管的尖端将与另一血管相遇,融合并疏通,所有的新血管将再次静止,”他补充道。
P38α及其参与肿瘤血管生成
内布雷达的小组研究细胞是如何接收、解释并对信息做出反应的。“我们的主要利益包括;肿瘤细胞稳态和化疗耐药性的机制,癌细胞和基质细胞之间的相互作用,以及靶向治疗,”Nebreda解释道。
该团队的注意力更具体地指向p38丝裂原活化蛋白激酶(MAPK)信号通路。通过分子和细胞研究的结合以及小鼠模型的使用,他们已经能够分析这种途径在活的有机体内研究其在肿瘤血管生成中的作用。
“p38α是一种普遍存在的蛋白激酶,由压力、炎症细胞因子和其他刺激激活,”内布雷达解释说。
而不同的研究有p38α信号通路参与肿瘤起始的调控进步,它确切的在肿瘤微环境中的作用,以及如何肿瘤生长的原因仍不清楚.
虽然最初被认为是一种肿瘤抑制因子,但越来越多的证据表明p38α可能具有双重功能——既是肿瘤抑制因子而且启动子-入不同类型的癌症.
Nebreda说:“我们实验室和其他实验室的工作提供了很好的证据,表明p38α信号通路通过作用于癌细胞和肿瘤基质的正常细胞而促进肿瘤的发展。”
在“正常”条件下组织的正常生长是通过身体维持“体内平衡”的能力来维持的。在促进血管生成(原血管生成)和抑制血管生成(抗血管生成)的因素之间。
Nebreda谈到了p38α在促血管生成因子和抗血管生成因子之间“打破平衡”的能力:“对培养癌细胞株的研究表明,p38α控制血管内皮生长因子(VEGF)的表达——这是一种关键的促血管生成因子。然而,也有证据表明p38α有时会负向调节内皮细胞的生存、增殖和分化,这表明p38α具有抗血管生成的特性。”
该小组最近在《科学》杂志上发表了一篇论文自然通讯描述了p38α在人和小鼠结肠癌血管生成调控中的作用。研究小组在间充质干细胞中发现了p38α的功能,这种细胞可以定位在血管周围。P38α通过特异性作用于间充质细胞抑制血管生成。通过化合物抑制p38α的活性而且遗传小鼠模型,他们能够刺激肿瘤中新血管的形成。
该论文的第一作者Raquel Batlle说:“我们的研究结果表明,间充质细胞中的p38α信号可以负向调节肿瘤中的血管生成程序。”
非血管生成肿瘤的发现
在20世纪90年代中期,佩泽拉的实验室发现一些晚期和侵袭性肺癌能够生长没有任何新血管的形成。研究小组观察到肺肿瘤“生活在”正常的肺组织中,癌细胞占据肺泡(肺内的小腔)。他们注意到,唯一存在的血管是属于“正常”肺组织的血管。
在描述这些肿瘤的前两篇论文发表后,在1996而且1997我们开始研究它们的主要特征,”佩泽拉解释说。
最初的数据表明,这些非血管生成肿瘤实际上仍然缺氧,一些血管生成因子过度表达,尽管如此,血管生成没有被诱导。
Pezzella还指出:“大多数肿瘤表现出血管生成而且非血管生成部分,在病程中,原发性血管生成癌可复发并伴有非血管生成转移,反之亦然。”
研究小组现在正致力于了解情况为什么而且如何细胞决定以非血管生成方式而不是以血管生成方式行为(反之亦然)。Pezzella解释说,其他研究小组已经开始研究癌细胞利用先前存在的血管的机制:“这一过程已经被命名。”血管吸收它是一种可以被干扰的活性机制,导致细胞死亡和/或抑制癌症进展。血管吸收会有影响癌症进展、转移而且病人对治疗的反应.虽然驱动这一过程的确切机制尚不清楚,但肿瘤细胞的侵袭和肿瘤细胞的粘附途径都是如此都扮演了什么角色.
自从20年前Pezzella的发现以来,在肝脏、大脑和淋巴结等其他器官中也发现了许多其他非血管生成肿瘤。
Pezzella指出:“由于这些器官中的每一个显然都与肺和彼此非常不同,非血管生成癌细胞的性质和吸收机制似乎与肺肿瘤不同。”
治疗靶向血管生成
调控血管生成是治疗癌症的一种方法。有很多抗血管生成的策略,包括:
- 增加抗血管生成因子的活性,试图“重新平衡”或抑制血管生成
- 抑制癌细胞获取生长所需的重要营养物质的能力
- 破坏负责“供养”肿瘤的现有血管。
- 针对缺氧诱导因子防止新血管形成
一些抗血管生成药物已经被开发出来,其中一些已经被fda批准用于治疗癌症。大多数药物靶向VEGF,它的受体或者激活的信号通路,例如,贝伐珠单抗,aflibercept和ramucirumab.然而,不同肿瘤类型的疗效不一致,一些患者可能对这些疗法产生耐药性。
Pezzella详细阐述了与这类药物相关的一些挑战:“在动物模型和人体试验中,已经观察到抗血管生成治疗期间肿瘤的进展。如此令人失望的结果的主要原因之一与“通用机制”促进血管生成的假设有关——抗血管生成治疗以一种“地毯式轰炸方法”给予每个人,而没有寻找可能比其他人更敏感的肿瘤患者。
与上述抗血管生成策略相反,有证据表明血管促销活动而不是抑制,可能是改善癌症治疗的可行策略——通过促进化疗药物的输送。
Batlle根据他们对p38α参与血管生成的理解解释了这一概念:“我们已经描述了一种调节血管形成的新机制,这表明p38α抑制剂可能有助于以可控的方式增强肿瘤血管,并促进基于化疗的癌症治疗。”
“因此,我们的数据提供了额外的证据,支持血管促进可能是改善癌症治疗的有效策略。”Batlle还指出,血管促进可能与较少的缺氧和较少的粘连增生有关,这两个过程的减少已被报道可减少胰腺导管腺癌的转移。
对肿瘤血管生成机制的更清晰的理解使研究人员能够开发出能够同时靶向多种途径的抗血管生成药物。此外,对调节血管生成的因素(如p38α)的更深入了解正在推动利用增强的血管生成对抗癌症的新策略。
“随着对癌细胞和血管之间相互作用的更全面了解,我们可以设计出新的‘循证’治疗方法,可以针对新血管的形成。而且劫持现有的血管,以及寻找针对非血管生成或血管生成癌细胞的新靶点,”Pezzella总结道。



