关键技术在结构生物学、自己的优势和局限性
结构生物学的科学领域,使用各种技术来确定生物分子的三维结构,如蛋白质,核酸及其复合物。这些技术允许研究人员阐明分子结构在不同的决议,从原子到超分子水平。此外,结构生物学的重点是研究生物分子相互作用和动态,即分子如何相互作用和随时间变化的。这是至关重要的对于理解生物分子的功能及其在健康和疾病中的作用。
结构生物学中使用的技术是什么?
结构生物学中所使用的主要技术包括x射线晶体学、核磁共振(NMR)光谱和低温电子显微镜(低温电子显微镜),通常辅以其他方法,如交联质谱(XL-MS)、小角x射线散射(粉煤灰)、中子衍射,水解、圆二色性(CD)和电子顺磁共振光谱(EPR)。计算方法和技术的进步也起到了重要作用在结构生物学,提供新的方法来分析、解释和集成数据从不同的技术。这使得研究者更深入的了解生物分子及其相互作用,动态和与生物过程的关系。让我们考虑这些关键技术,他们在结构生物学的角色和他们的长处和局限性。
低温EM
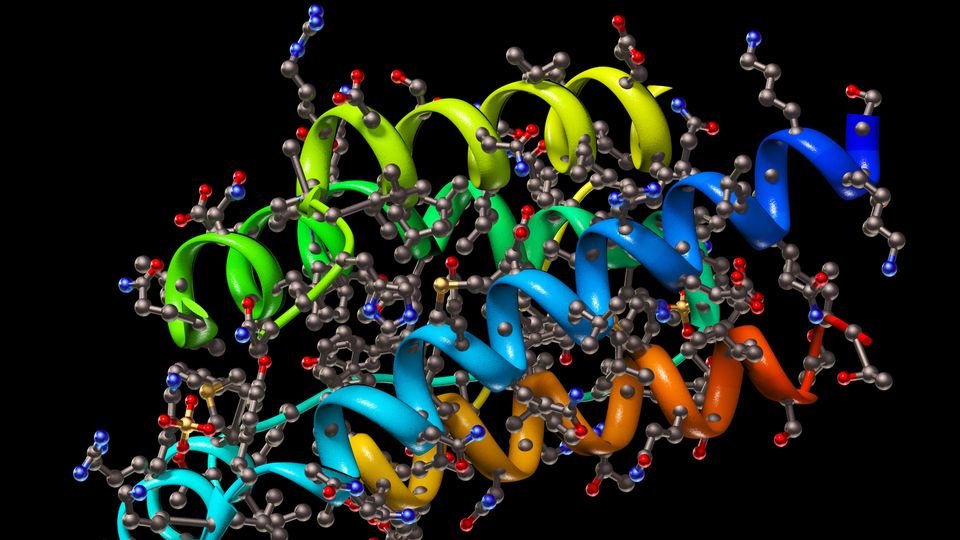
低温电子显微镜是一种电子显微镜技术的样品进行低温治疗前分析。一般来说,它是应用于蛋白质的结构研究,特别是那些不能被其他技术研究,如大蛋白复合物膜蛋白质或蛋白质并不会形成晶体。这种技术可以让图像与near-atomic决议获得(与x射线晶体学、核磁共振光谱学)由于电子束在样品间的相互作用。Cryogenizing样例有利于保护本地的分子结构。由于仪器和软件的最新发展,可以处理大量的图像样本(例如,一种蛋白质)的自动重建与near-atomic分辨率的三维结构(图1)。1,2,3,4
关于它的局限性,在低温电子显微镜样品制备是艰苦和一些蛋白质复合物可以毁灭的过程。低温电子显微镜仪器和维护代价高昂,生成的大量数据需要一个伟大的计算来处理它。最后,还有一个限制蛋白质的大小,可以使用低温电子显微镜分析,因为低于一定规模,获得的图像显示非常低的信噪比。1,2,3,4

图1: 工作流的蛋白质结构说明了低温电子显微镜。信贷:技术网络。188金宝搏备用
X射线晶体学
这项技术是基于事实的水晶样品能够引起入射x射线的衍射,生成一个特征模式,可以用来推断出晶体的结构在原子水平。结晶样品与x射线辐照在不同入射角度。x射线散射造成的命令示例生成的原子结构特征模式,由一个传感器记录。整个组模式在不同入射角度获得允许,通过信息处理、电子密度的样本推断,可以构建在原子尺度结构模型(图2)。5,6,7,8,9
x射线晶体学是结构生物学技术水平最高的分辨率。这是行之有效的,具有自动化程度高、相对便宜的相对于其他结构生物学方法。结构解析处理数据采集后很快。从理论上讲,没有大小限制可以通过x射线晶体学分析的分子,但是有限制的缓解样品结晶。大型、复杂的分子通常很难结晶,尤其是当他们包含动态领域,如灵活的地区或附加的碳水化合物。即使有可能生成晶体的复杂分子,有时很难阐明它们的结构与良好的分辨率。最后,结晶过程会影响分子结构的方式意味着最终阐明结构可以完全不同的本机在生理条件下发现。5,6,7,8日,9,10

图2: 通过x射线晶体学蛋白质结构测定的步骤。信贷:技术网络。188金宝搏备用
x射线辐射高能,样品晶体用于x射线晶体学测量前必须与液氮瞬间冷冻最小化样本损伤和减少热运动产生的噪音。在过去的十年中,x射线结晶学的一个变体developed-serial飞秒结晶学(SFX)——否定这一需要。SFX位于x光射线源的使用,被称为x射线自由电子激光(XFEL),这是能够产生非常强烈的x射线的非常短的脉冲持续时间(在fs = 10-15年。这些脉冲是如此强大,他们完全破坏样品晶体。因此,有必要进行序列分析的大量随机取向的晶体(> 100000),说明样品的分子结构。为了达到这个目标,包含的小晶体样品的液体喷射注入XFEL室和辐照。脉冲极快,成千上万的晶体进行了分析在很短的时间内(图3)。这种方法的优点是,晶体可以小得多比用传统的x射线晶体学和不需要快速冷冻前测量,因此,实验可以在室温下进行。此外,SFX能够给分子动力学信息。11,12,13,14,15

在药物发现的背景下,蛋白质是小说的主要目标药物的候选人。出于这个原因,这是一个主要的兴趣在结构生物学领域的说明越来越多的蛋白质的结构。程序获得的进步迅速从蛋白质晶体样品的发展导致了所谓的高通量(HT)晶体学。这种方法是基于使用自动化系统、小型化和流程集成为了获得大量的结晶样品,可以在很短的时间内进行分析,生成大量的数据集在一个非常有效的方法。这种技术不仅可以快速优化结晶条件,但也有用的候选药物进行大规模筛查目标蛋白质。17,18,19,20.,21,22
核磁共振光谱学
核磁共振光谱学利用物理现象的原子核与射频辐射,达到兴奋的能量状态。当核恢复他们的基本的能量状态,他们发出的辐射探测器收集到的(图4)。辐射检测的频率取决于原子核及其强度的化学环境有关的数量相同的原子核。有多种类型的核磁共振实验,提供不同的化学元素(例如,信息1H,2H,13C和15N),连接或空间距离。23
- 大分子结构说明
- 大分子动力学的研究
- 表征生物分子之间的相互作用的机制
对于结构说明,数据通过核磁共振光谱学使原子和键角之间的距离计算。使用这些距离和角度值执行计算的计算结构的限制。在分子动力学的情况下,一些核磁共振实验是用来分析结构的灵活性和弛豫参数估计。最后,有很多实验核磁共振方法检测分子之间的相互作用和识别所涉及的原子,使交互机制的理解,一些非常相关的药物发现领域。23,24,25,26,27
核磁共振光谱学的研究特别有用生物分子在本地的情况下,它通常是在水溶液中进行的。这是一个非常多才多艺,非破坏性技术由于大量的面向不同的实验来分析不同分子方面。低温电子显微镜和x射线晶体学、核磁共振光谱学是一种最方法用于生物分子的结构的决心。24,25,26,27
然而,核磁共振光谱法有其局限性。首先,工具和维护非常昂贵。第二,它的敏感性较低,因为大多数的原子核可以对应于同位素分析显示低自然出现。这意味着,许多生物分子样品必须在某些同位素(如浓缩13C或15N),一个昂贵的过程。此外,分子的大小有限制,可以分析解决方案核磁共振光谱学因为大分子在水溶液中会影响样品的均匀性,这是一个临界点。在这些情况下,固态核磁共振光谱学可以替代。23,24,25,26,27

图4: 核磁共振光谱学工作流对蛋白质结构的决心。信贷:技术网络。188金宝搏备用
交联质谱(XL-MS)
XL-MS是一个类型的质谱分析(MS)分析生物样品的分离出蛋白质大分子复合物,细胞器、细胞或组织或器官)与交联剂治疗。然后,样本受到一个酶蛋白水解作用,随后分析了液相色谱法耦合串联质谱(质/女士)。28,29日,30.,31日,,32,33,34
交联剂的治疗会导致很多不同地区之间的附件样品中蛋白质或其他分子相互作用。当样品通过蛋白质水解,蛋白质样本的片段,但交联地区将保持连接。自交联的长度,计算分析结果数据将建立蛋白质之间的距离限制和识别哪些是相互作用的。把所有这些数据结合起来,可以描述蛋白质交互网络出现在示例(图5)。28,29日,30.,31日,32,33,34
XL-MS是一种高度敏感的技术能够检测和识别极低量的分析物(~ 10-15年摩尔)。与其他技术相反,是没有限制的大小和复杂性研究分子,女士的分析是进行蛋白质片段。自交联反应可以在生理条件下进行的,结果将反映本地条件。这种技术的主要贡献是伟大的能力来生成高通量蛋白质相互作用网络的信息,尤其是在具有挑战性的系统等内在无序蛋白质(idp)。28日,29日,30.,31日,32,33,34
是非常重要的,以确保高质量的女士数据获得在该技术减少歧义的作业交联的物种。孤立的完整说明蛋白质或蛋白质复合物是不可能通过使用XL-MS孤独,有必要使用互补的技术,如低温电子显微镜。28,29日,30.,31日,32,33,34

图5: 总体方案的一个典型的交联质谱(XL-MS)实验。信贷:技术网络,188金宝搏备用改编自低et al ., 2021。 35
小角x射线散射(粉煤灰)
粉煤灰技术基于弹性散射x射线光子与样品相互作用后,和收集的辐射在小角度倾斜(通常,0.1 -10°)对原束轨迹。36,37,38,39,40
在一个典型的一枝实验中,样品与x射线和辐射散射辐照在低角度注册和衰减强度表示为一条曲线。这条曲线的数学分析使参数估计与分子的大小和形状有关。使用ab在开头计算造型一枝数据,可以构建低分辨率的分子模型是非常有用的,以确定全球高分子的形状或结构域的一般配置在一个蛋白质(图6)。在这方面,这些模型可以结合高分辨率的蛋白质结构域解决其他技术(如x射线晶体学、核磁共振光谱学)获得分子结构的更详细的描述。36,37,38,39,40
粉煤灰是一个有用的工具研究非晶的生物分子结构在低分辨率。广泛的分子大小(从kDa GDa)和条件(从本土极端)可以用这种方法进行分析。此外,粉煤灰能够提供信息动力学和分子动力学过程。一枝需要少量样品,通常不是毁在测量期间,它可以作为液体,准备解决方案或粉末。36,37,38,39,40
粉煤灰的主要限制是它的低分辨率与其他技术相比,特别是在解决方案或部分有序样本。获得解决,有必要采用强大的x射线源,如同步加速器,它只在大型研究机构,因为他们的成本和大小。随着蛋白质不稳定分子,一些损害可能发生在测量。36,37,38,39,40

图6: 一枝实验获得的实验设计方案结构蛋白质样本的信息。信贷:技术网络。188金宝搏备用
中子衍射
中子衍射技术是基于样品的辐照中子束在不同入射角度。中子与样品的分子之间的相互作用引起散射,产生一个特征模式取决于样本结构在原子水平(图7)。从这个意义上说,基本面,而类似于x射线衍射技术,但是最主要的区别是中子的高渗透能力比x射线。出于这个原因,可以获取的信息样本无论其厚度。中子能够与原子核相互作用,而不是与他们周围的电子云(x射线一样)。因此,中子衍射同位素差异非常敏感。6,41,42,43,44,45
中子衍射分析的样品必须的形式结晶粉末,虽然可以使用孤立的晶体如果他们足够大(大于所需的x射线晶体学)。散射模式得到这种技术对分子进行分析提取结构数据,类似于x射线晶体学(图7)。尽管如此,一个中子衍射的优点对x射线衍射对氢原子提供信息的能力。这些原子在x射线辐射下几乎看不见是因为他们有一个非常低的电子密度。相反,中子衍射能提供氢键的信息样本和水分子的取向。此外,该技术可以应用于分子的动态属性的研究,因为它有一个高空间和时间分辨率。6,41,42,43,44,45
中子衍射技术展现出一些优势相比,其x射线,如它能提供涉及光原子的结构信息,如氢和其不同同位素之间的辨别的能力。然而,这种技术提供了一些重要的缺点。首先,中子源是非常昂贵的建设和维护。其次,单晶分析,样例必须远远超过那些用于x射线晶体学。最后,这种技术可能需要长时间实验获得必要的数据来获取高分辨率结构信息。6,41,42,43,44,45

图7: )计划的一个典型的中子衍射实验和由此产生的光谱。B)中子衍射光谱拟合相关分子的形成和结构因素进行了分析。信贷:卡斯特罗et al ., 2017年, 46 复制下 Creative Commons 4.0国际4.0 (CC)许可证 。
蛋白水解作用
一个有用的方法来解决蛋白质结构和形状包括对蛋白质样品分析前蛋白水解作用有限。蛋白质水解过程中,蛋白质被分解成更小的肽酶的水解肽氨基酸之间的债券。然而,蛋白质在原生状态相当抵抗蛋白质水解,在很多情况下只有一个肽键的过程中坏了。这一观点的原因是:蛋白酶只能够执行其功能蛋白质的地区一定程度的灵活性,如循环,因此有一个有限的活动。这可以解释为蛋白质水解肽债券发生位于二级结构元素需要之前的损失大量稳定的相互作用,使过程积极不利。47,48,49,50,51
有许多可以用来进行蛋白质水解蛋白酶,他们通常显示氨基酸特异性。有限的蛋白水解作用后,产生的肽可以被孤立,其他技术分析和识别(例如,质)(图8)。在这种情况下,蛋白质水解的方法可以用来识别灵活的区域和结构域蛋白质,蛋白质折叠研究通过生成折叠中间体,然后进行有限的蛋白水解作用和描述蛋白质聚合过程。47,48,49,50,51
有限的蛋白水解作用的优势其他技术是适用于样品的解决方案,也就是说,在本地条件。此外,它是一种简单和便宜的方法与其他物理化学技术相比,它不需要任何特殊的工具或大量的样本。然而,有限的蛋白水解作用不是一个高分辨率的技术,它是必要的补充与隔离和分析过程涉及更敏感的技术,如质。47,48,49,50,51

图8: 实验工作流程研究protein-drug交互使用有限的蛋白质水解方法。信贷:技术网络,188金宝搏备用改编自Holfeld et al ., 2023。 52
圆二色性(CD)
CD光谱技术基于圆偏振光与物质之间的相互作用。电磁辐射是由电场振荡磁场(在垂直地xy飞机)。飞机包含两个字段,反过来,垂直于方向波传播(z轴)。辐射极化时,其电场振荡与特定的几何定位。在圆偏振的情况下,辐射的电场旋转以恒定速率描述一个周长。这可以顺时针旋转(右圆偏振光,RCP)或逆时针方向(左圆偏振光,连结控制协定)。圆偏振辐射能够与光学活性的分子(手性分子);这些分子包含一个或多个原子是绑定到四个不同的取代基。53,54,55,56,57
在一个典型的CD光谱实验中,样品辐照与一系列不同波长的圆偏振光,通常从紫外可见范围。蛋白质是光学活性的分子,它们能吸收辐射的一部分。RCP和连结控制协定不同被样品吸收,这种差异(Δε)被称为“圆二色性(图9)。实验结果显示代表Δε作为波长的函数。合成曲线的形状可以与蛋白质的二级结构(图9 b),在某些情况下可以获得定量估计的一些二级结构元素的内容。53,54,55,56,57
CD光谱是一个简单的和相对廉价的技术,它允许信息获得的二级结构和折叠/展开的蛋白质和多肽。CD实验是容易执行和不是很耗时。蛋白质和肽可以在本地条件,研究了在溶液中进行测量,只需要低浓度的分析物(~μM)。53,54,55,56,57
这种技术的局限性包括一些化学物种可以干涉测量(在同一波长吸收的物质,如许多缓冲区和氯)。很难推断出详细的复杂分子结构信息,和二级结构元素是唯一可靠的量化分析小肽。53,54,55,56,57

图9: 圆二色性的)计划实验表明CD谱仪的所有元素。B)的例子不同元素的典型CD光谱在蛋白质二级结构。信贷:Pignataro et al ., 2020年, 58 复制下 Creative Commons 4.0国际4.0 (CC)许可证 。
电子顺磁共振光谱(EPR)
电子顺磁共振谱是基于微波辐射之间的交互和未配对电子的电子自旋。的工作原理非常类似于核磁共振光谱学:样本被放置在一个外部磁场,然后用微波辐射辐照(核磁共振射频)所吸收的未配对电子(原子核在NMR),到达激发态。当未配对电子恢复他们的基本的能量状态,样品发出辐射检测和加工生成EPR谱,从各种类型的结构信息可以推导出(图10)。59,60,61年,62年,63年,64年
生物分子通常不顺,这意味着它们不包含未配对电子(顺磁分子,如自由基,是非常不稳定的)。因此,有必要将他们转变为顺磁性分子EPR前分析。最常见的方法是通过使用spin-labeling方法,包括将一个无电抗顺化工集团(通常是氮含量组)的生物分子。的蛋白质,定点spin-labeling (SDSL)是用来介绍未配对电子在特定的氨基酸。EPR可以用来研究生物分子的许多方面,如分子运动和动力学和不同的二级结构元素的存在。通过这种方法,还可以获得测量分子内的顺磁中心之间的距离。那些距离可以作为约束建立分子模型。59,60,61年,62年,63年,64年
EPR谱提供了一种高空间(nm)和时间(ps-μs)敏感性,这是非常有用的研究蛋白质动力学,特别是在高度动态的蛋白质(如国内流离失所者)。尽管有必要使用旋转标签分析分子,他们的体积小系统中生成最小扰动。没有大小限制的分子分析和光谱比其他技术简单只有未配对电子是可见的。这种技术提供了相关结构信息,但它应该是补充与其他高分辨率技术来得到一个完整的分析生物分子结构模型。此外,自旋电子夫妇与附近的核自旋导致信号分割和扩大,从而降低分辨率。59,60,61年,62年,63年,64年

图10: 典型电子顺磁共振波谱仪的方案。B)面向电子顺磁共振光谱的实验研究蛋白质折叠的存在和缺乏蛋白质激活。这些光谱反映了蛋白质折叠的改变在本机和错误折叠状态,和活跃的和不活跃的形式之间的正确折叠的蛋白质。信贷:技术网络,188金宝搏备用改编自Balo et al ., 2019。 65年
找出更多关于结构生物学,它可以告诉我们和它的应用程序,请访问下面的文章。
引用
1。
伯爵,Falconieri V,米尔恩JLS组合、苏s低温电子显微镜:超出了显微镜。当今Struc生物学观点》。2017;46:71 - 78。doi:10.1016 / j.sbi.2017.06.002
2。
诺加利斯E,谢尔SHW。低温电子显微镜:一个惟一的大分子复杂的可视化工具。摩尔细胞。2015年。58 (4):677 - 689。doi:10.1016 / j.molcel.2015.02.019
3所示。
白得到,麦克马伦G,谢尔SHW。如何对结构生物学低温电子显微镜。学生物化学趋势Sci。2015;(1):40 49-57。doi:10.1016 / j.tibs.2014.10.005
4所示。
Egelman,嗯。当前低温电子显微镜的革命。Biophys J。2016;110:1008 - 1012。doi:10.1016 / j.bpj.2016.02.001
5。
Ameh ES。回顾基本晶体学和x射线衍射的应用程序。Int J难以开发技术。2019;105:3289 - 3302。doi:10.1007 / s00170 - 019 - 04508 - 1
6。
在结构生物学艾格力m .衍射技术。咕咕叫Protoc核酸化学。2017;65:7.13.1-7.13.41。doi:10.1002 / cpnc.4
7所示。
Maveyraud L, Mourey L .蛋白质x射线晶体学和药物发现。分子。2020;25 (5):1030。doi:10.3390 / molecules25051030
8。
Muench SP、Antonyuk SV哈斯奈英党卫军。扩大结构生物学工具箱:同步加速器,x射线激光和低温电子显微镜。IUCrJ。2019;6:167 - 177。doi:10.1107 / S2052252519002422
9。
施y的结构生物学通过x射线晶体学。细胞。2014;159 (5):995 - 1014。doi:10.1016 / j.cell.2014.10.051
10。
Acharya KR,劳埃德。蛋白质晶体结构的优点和局限性。趋势杂志Sci。2005;26 (1):10 - 14。doi:10.1016 / j.tips.2004.10.011
11。
约翰逊LC, Stauch B, Ishchenko Cherezov诉一个光明的未来与XFELs连环飞秒晶体学。学生物化学趋势Sci。2017年。42 (9):749 - 762。doi:10.1016 / j.tibs.2017.06.007
12。
Martin-Garcia JM,康拉德CE, Coe J, roy chowdhury年代,Fromme p系列飞秒结晶学:在结构生物学革命。学生物化学拱Biophys。2016;602:32-47。doi:10.1016 / j.abb.2016.03.036
13。
奥维尔。最近的结果及时解决在XEFLs连环飞秒晶体学。当今Struc生物学观点》。2020;66:193 - 208。doi:10.1016 / j.sbi.2020.08.011
14。
是我连续飞秒结晶学:第一个五年。IUCrJ。2015;2 (2):246 - 255。doi:10.1107 / S205225251402702X
15。
佩利DW Schriber EA, Bolotovsky R。,Rosenberg DJ, Sierra RG, Aquila A, et al. Chemical crystallography by serial femtosecond X-ray diffraction.自然。2022;601 (7893):360 - 365。doi:10.1038 / s41586 - 021 - 04218 - 3
16。
刘H & Lee w .蛋白质晶体学:发展和观点。Int J摩尔Sci。2019;20 (14):3421。doi:10.3390 / ijms20143421
17所示。
逗我,Sharff VinkovićM,你J, Jhoti h .高通量蛋白质晶体学和药物发现。化学Soc牧师。2004;33:558 - 565。doi:10.1039 / B314510G
18岁。
Sutanto F, Shaabani年代,Oerlemans R,厄里斯D,帕蒂尔P,尹浩然,Hadian。结合高通量合成和高通量蛋白质晶体学加速识别。Angew化学Int艾德。2021;60:18231 - 18239。doi:10.1002 / anie.202105584
19所示。
史蒂文斯RC。高通量蛋白质结晶。当今Struc生物学观点》。2000;10 (5):558 - 563。doi:10.1016 / s0959 - 440 x (00) 00131 - 7
20.
Sharff, Jhoti h .高通量结晶学来提高药物发现。当今化学生物学观点》。2003;7 (3):340 - 345。doi:10.1016 / s1367 - 5931 (03) 00062 - 0
21。
Rupp b高通量结晶学以合理代价:结核病结构基因组学财团结晶设施。Acc化学物。2003;36 (3):173 - 181。doi:10.1021 / ar020021t
22。
商誉柯、坦南特毫克,史蒂文斯RC。高通量x射线晶体学为基于结构的药物设计。今天药物越是加大。2001;6 (15):S113-S118。doi:10.1016 / s1359 - 6446 (01) 00169 - 6
23。
伍斯里奇K。在溶液中蛋白质结构测定核磁共振光谱学。J临床生物化学。1990;265 (36):22059 - 22062。doi:10.1016 / s0021 - 9258 (18) 45665 - 7
24。
Sugiki T, Furuita K,藤原T,小岛c NMR技术基于结构的药物发现。分子。23 (148):1-27。doi:10.3390 / molecules23010148
25。
Opella SJ, Marassi调频。膜蛋白的应用核磁共振。学生物化学拱Biophys。2017;628:92 - 101。doi:10.1016 / j.abb.2017.05.011
26岁。
Markwick PRL, Malliavin T, Nilges m .由NMR结构生物学:结构、动力学,和交互。公共科学图书馆第一版杂志。2008;4 (9):e1000168。doi:10.1371 / journal.pcbi.1000168
27。
Van der嗯,PCA。新的固态核磁共振在结构生物学中的应用。紧急情况前生命科学。2018;2:57 - 67。doi:10.1042 / ETLS20170088
28。
Iacobucci C, Sinz答:生存还是毁灭?五个指导方针,避免在交联misassignments /质谱。肛门化学。2017;89:7832 - 7835。doi:10.1021 / acs.analchem.7b02316
29。
Iacobucci C,格策,Sinz a .交联/质谱得到进一步对蛋白质交互网络。当今生物技术。2020;63:48-53。doi:10.1016 / j.copbio.2019.12.009
30.
费舍尔L,陈咱Rappsilber j .定量交联/质谱使用isotope-labelled cross-linkers。J蛋白质组学。2013;88:120 - 128。doi:10.1016 / j.jprot.2013.03.005
31日。
Piersimoni L, Sinz a .交联/质谱在十字路口。肛门Bioanal化学。2020;412:5981 - 5987。doi:10.1007 / s00216 - 020 - 02700 - x
32。
Sinz a .交联/质谱为研究蛋白质结构和蛋白质-蛋白质之间的关系:我们现在在哪儿,我们应该从这里吗?Angew化学Int艾德。2018;57:6390 - 6396。doi:10.1002 / anie.201709559
33。
于C,黄l .交联质谱(XL-MS): interactomics和结构生物学的新兴技术。肛门化学。2018;90 (1):144 - 165。doi:10.1021 / acs.analchem.7b04431
34。
唐X, Wippel HH,查韦斯JD,布鲁斯我。交联质谱:结构生物学和系统生物学之间的联系。蛋白质科学。2021;30:773 - 784。doi:10.1002 / pro.4045
35。
泰低,Syafruddin SE, Mohtar MA Vellaichamy,拉赫曼国家安全局,箱型雪撬yf, Tan CSH。最近进展质量spectrometry-based策略来阐明蛋白质-蛋白质之间的关系。细胞摩尔生命科学。2021;78:5325 - 5339。doi:10.1007 / s00018 - 021 - 03856 - 0
36。
Doniach美国生物分子构象的变化被小角x射线散射。化学牧师。2001;101:1763 - 1778。doi:10.1021 / cr990071k
37岁。
Grawert TW, Svergun DI。结构建模用小角x射线散射(粉煤灰)的解决方案。J杂志。2020;432:3078 - 3092。doi:10.1016 / j.jmb.2020.01.030
38。
Lipfert J, Doniach美国小角x射线散射从RNA,蛋白质和蛋白质复合物。为Biophys结构。2007;36:307 - 327。doi:10.1146 / annurev.biophys.36.040306.132655
39岁。
MV,波图霍夫Svergun DI。小角x射线散射biomacromolecular的应用解决方案。Int J生物化学计算单元B。2013;45 (2):429 - 437。doi:10.1016 / j.biocel.2012.10.017
40。
Kikhney AG) Svergun DI。一个实用指南,小角x射线散射(粉煤灰)的灵活和内在无序蛋白质。2月让。589 (19):2570 - 2577。doi:10.1016 / j.febslet.2015.08.027
41岁。
Blasie JK, Timmins p .中子散射在结构生物学和生物分子材料。牛夫人。24 (12):40-47。doi:10.1557 / S0883769400053719
42。
布莱克利正在MP,兰甘过世P, Niimura N, Podjarny中子结晶学:机遇,挑战,和局限性。当今Struc生物学观点》。2008;18:593 - 600。doi:10.1016 / j.sbi.2008.06.009
43。
布朗Hoogerheide DP、福赛斯VT KA。中子散射结构生物学。今天的今天。2020;73 (6):36-42。doi:10.1063 / PT.3.4498
44岁。
河野F, K,栗原君Tamada t现状结构生物学的中子晶体学。BPPB。2022;19:e190009。doi:10.2142 / biophysico.bppb-v19.0009
45岁。
Niimura n中子结构生物学领域的扩张。当今Struc生物学观点》。1999;9 (5):602 - 608。doi:10.1016 / s0959 - 440 x (99) 00012 - 3
46岁。
Castellanos MM, McAuley柯蒂斯我。研究蛋白质的结构和动态使用中子散射在无定形的阶段。第一版结构生物技术J。2017;15:117 - 130。doi:10.1016 / j.csbj.2016.12.004
47岁。
刘段Y, Y,克·R,钟w .映射在纳米粒子与分子结构的蛋白质定位的蛋白水解作用有限。肛门化学。2019;91:4204 - 4212。doi:10.1021 / acs.analchem.9b00482
48。
丰塔纳,Laureto PP、Spolaore B, Frare E, Picotti P, Zambonin m .探索蛋白质结构的蛋白水解作用有限。Acta Biochim波尔。2004;51 (2):299 - 321。doi:10.18388 / abp.2004.3573
49。
丰塔纳,Laureto PP、Spolaore B, Frare大肠识别蛋白质由无序地区有限的蛋白水解作用。:Uversky V, Dunker, eds。内在无序蛋白质分析。分子生物学方法。纽约:施普林格;2012:297 - 318。doi:10.1007 / 978 - 1 - 4614 - 3704 - 8 - _20
50。
丰塔纳,Laureto PP、菲利皮主持V, Scaramella E, Zambonin m .探测蛋白质的部分折叠态蛋白水解作用有限。1997;2 (2):R17-R26。doi:10.1016 / s1359 - 0278 (97) 00010 - 2
51。
医学博士Kazanov Igarashi Y, Eroshkin, Cieplak P, Ratnikov B,张Y, Z, Godzik,奥斯特曼,Smit JW。有限的蛋白水解作用的结构性因素。J蛋白质组Res。2011;10:3642 - 3651。doi:10.1021 / pr200271w
52岁。
Holfeld, Quast JP, Bruderer R, Reiter L, de Souza N, Picotti p有限proteolysis-mass谱识别metabolite-protein交互。:Skirycz, Luzarowski M,埃瓦尔德JC (eds)。它是metabolite-protein交互的识别。冰毒杂志。2023;2554:69 - 89。doi:10.1007 / 978 - 1 - 0716 - 2624 - 5 _6
53岁。
凯利SM,价格数控。利用圆二色性蛋白质结构和功能的调查。咕咕叫蛋白质Pept Sc。2000;1 (4):349 - 384。doi:10.2174 / 1389203003381315
54。
凯利SM Jess TJ,价格数控。如何研究蛋白质通过圆二色性。Biochim Biophys学报。2005;1751 (2):119 - 139。doi:10.1016 / j.bbapap.2005.06.005
55。
马丁•SR Schilstra乔丹。圆二色性生物分子的研究及其应用。方法细胞生物。2008;84:263 - 293。doi:10.1016 / s0091 - 679 x (07) 84010 - 6
56。
吉尔Ranjbar B, p .圆二色性技术:生物分子和nanostrucural分析——一个回顾。化学生物药物洗脱支架。2009;74:101 - 120。doi:10.1111 / j.1747-0285.2009.00847.x
57。
惠特莫尔L,华莱士英航。蛋白质二级结构从圆二色性光谱分析:方法和参考数据库。生物聚合物。89 (5):392 - 400。doi:10.1002 / bip.20853
58岁。
Pignataro MF, Herrera毫克,Dodero VI。评价肽/蛋白自组装和聚合光谱方法。分子。2020;25 (20):4854。doi:10.3390 / molecules25204854
59。
库恩Biswas R, H, Brudvig GW,格帕兰诉利用电子顺磁共振光谱学研究大分子的结构和功能。Sci掠夺。2001;84 (1):45 - 68。doi:10.3184 / 003685001783239050
60。
Drescher m . EPR在蛋白质科学。:Drescher M, Jeschke G, eds。电子顺磁共振光谱。柏林:施普林格。2011:91 - 119。doi:10.1007/128 _2011_235
61年。
Jeschke g .现代EPR结构生物学的贡献。紧急情况前生命科学。2018;2:9-18。doi:10.1042 / ETLS20170143
62年。
杨李H,潘Y, Z, ChenB Rao J。定点旋转标签的新兴应用电子顺磁共振(SDSL-EPR)研究食物蛋白质结构,动力学,和互动。趋势食品科学技术。2021;109:37-50。doi:10.1016 / j.tifs.2021.01.022
63年。
Sahu ID、McCarrick RM Lorigan GA。利用电子顺磁共振来解决化学问题。生物化学。2013;52:5967 - 5984。doi:10.1021 / bi400834a
64年。
Sahu ID, Lorigan GA。电子顺磁共振研究膜蛋白的工具。生物分子。2020;10 (5):763。doi:10.3390 / biom10050763
65年。
Balo AR,李J,恩斯特相机会固定相EPR谱监测膜蛋白质重折叠构象的反应。肛门化学。2019;91:1071 - 1079。doi:10.1021 / acs.analchem.8b04542




