研究了星形胶质细胞和小胶质细胞在神经退行性疾病的作用:体内动物模型和体外细胞培养吗?

神经退化涉及结构和/或功能的逐渐丧失的神经元与神经退行性疾病相关的主要病理学,如阿尔茨海默氏症、多发性硬化、帕金森病。这些严重的和无法治愈的神经退行性疾病是严重的健康和经济挑战,特别是在发达和人口老龄化社会。例如,世界卫生组织估计,2015年全球总死亡人数的12%是由于神经系统失调,和数以百万计的患者的生命受到相关的生理和心理障碍,如运动障碍和记忆丧失(1)。
病理和生理研究逐渐发现神经退行性疾病的复杂神经机制上揭示潜在的治疗途径。揭示了一个重要的突破,疾病non-cell自治机制,要求损伤神经元内及其邻近细胞的融合:星形胶质细胞和小胶质细胞。这些细胞是至关重要的中枢神经系统的维护,以及他们的活动和功能障碍已经涉及各种神经退行性疾病的病理,从而刺激极大的兴趣在他们的潜在的治疗目标(2、3)。
然而,尽管有价值,研究传统在活的有机体内方法采用动物模型(通常是老鼠),这是有限的人类生理相关性和翻译。因此,近年来开发的新方法,包括先进在体外细胞培养技术,如三维基本神经细胞共培养,现在显示承诺推进研究和小说产生疾病的疗法。
星形胶质细胞和小胶质细胞:教训动物模型
虽然星形胶质细胞和小胶质细胞曾经被认为是只有结构细胞,他们现在知道为许多重要的自我平衡的维护功能在中枢神经系统(CNS)(4)。星形胶质细胞支持邻近的神经元通过调节脑血流量,维持突触功能,神经细胞的新陈代谢,和神经递质合成,并接受明显的转变称为“活性astrocytosis”后的脑损伤和疾病(2、4)(图1)。
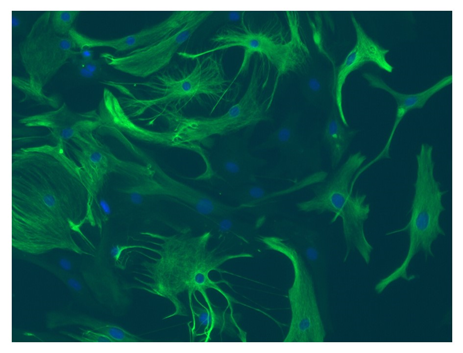
星形胶质细胞、小胶质细胞作为编程的巨噬细胞在中枢神经系统,调节大脑发育,维持神经网络,通过调节神经炎症和修复损伤和消除任何可能危及到中枢神经系统(3)的抗原(图2)。作为炎症反应的关键部件中枢神经系统损伤和疾病,小胶质细胞具有神经毒性和神经营养作用(5)。
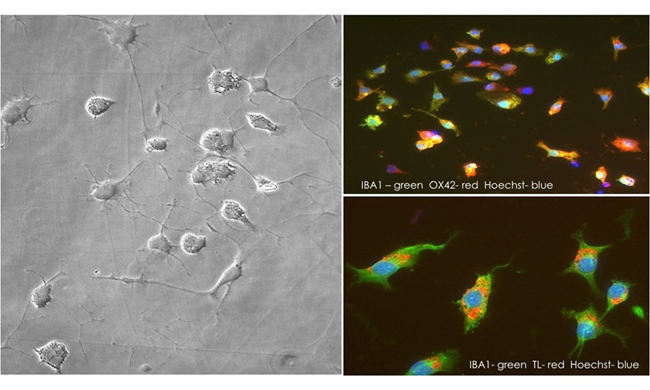
图2:低温贮藏老鼠大脑小胶质细胞、解冻、培养了两天。
在活的有机体内使用动物模型(即研究。疾病、遗传或化学模拟老鼠)表明,星形的变化和小胶质函数可以是神经退行性疾病的病理基础,包括肌萎缩性脊髓侧索硬化症(ALS)和帕金森病,通过他们的亲密接触脆弱的神经。
例如,分子遗传学方法产生了肌萎缩性侧索硬化症小鼠模型表现出年龄相关性,进步致命的麻痹和神经炎症,包括astrogliosis和microgliosis,这些都是标志人类ALS的(2)。研究也表明小胶质细胞激活和astrocytosis基础快速ALS(6)进展。此外,帕金森病的特征是黑质多巴胺能神经元的损失,和证据收敛作用的小胶质细胞和星形胶质细胞在帕金森病,如促炎症激活的小胶质细胞,来自化学诱导疾病的老鼠注射通过管理MPTP药物(6-tetrahydropyridine 1-methyl-4-phenyl-1、2、3), (7)。
是在活的有机体内动物模型最好的方法?
这些和许多其他的发现使星形胶质细胞和小胶质细胞被认为是神经退行性疾病的潜在治疗靶点,和最近的在活的有机体内研究利用动物模型在这方面取得了进展。例如,Elgueta et al。(2016)发现,多巴胺受体(D3)拮抗剂(PG01037)对帕金森病小鼠模型的治疗效果注射(MPTP药物老鼠)由于减少多巴胺神经元的损失,引起小胶质细胞和抗炎反应有益astrogliosis(8)。此外,Calvello et al。(2017)发现,补充维生素D的小鼠注射的饮食MPTP药物减毒的促炎症激活小胶质细胞(9)。
然而,尽管如此在活的有机体内研究利用动物模型生成有价值的发现,神经退行性疾病的神经生理学和病理学老鼠并不完全复制自己的。因此,在某些情况下,发现从动物性在活的有机体内研究很难转化为人类(10)。因此,他们可能会误导研究结果以及在药物筛选,可以增加下游临床试验的风险和成本。
因此,小说在体外细胞培养方法越来越先进可行,更多的生理神经退化的代表模型来阐明星形胶质细胞和小胶质细胞在这些疾病的作用。例如,人类诱导多能干细胞(万能)可以用来生成星形胶质细胞细胞培养(11)。另一个新行提供突破的研究已经使用三维培养的方法研究星形胶质细胞和小胶质细胞之间的相互作用可能是神经退行性疾病的基础。
三维在体外细胞培养:一个新的出路
新使用主要使细胞三维培养的方法在体外一代更有效地模拟不同的神经元模型在活的有机体内环境。这使得研究多细胞星形胶质细胞和小胶质细胞之间的相互作用如何构成神经退化,以及识别目标的新生物学途径治疗神经退行性疾病。
例如,Liddelow et al .(2017)使用三维在体外啮齿动物的神经元和星形胶质细胞共培养来描述小说的神经退化机制。他们发现,小胶质细胞激活炎性因子的新描述星形胶质细胞亚型,称为A1,诱发神经元死亡。此外,他们发现A1细胞中发现的疾病,阻止他们形成防止神经破坏,表明这可能是一个新的治疗方法(4)。
此外,Efremova et al。(2017)培养不灭的小鼠星形胶质细胞(IMA)与人类中脑的隆德(LUHMES)神经元和发现,炎症细胞因子组合降低了正常的支持提供了IMA的神经元,长期接触后,引发神经毒性。然而,神经毒性与抗炎药预防当研究人员有针对性的星形胶质细胞、神经元和星形上层清液的毒性预防目标与神经保护药物。因此,作者得出的结论是,这种共培养可以用于分析wto胶质/骨髓cell-directed和神经保护策略(12)。
最后,乌鲁蒂亚et al。(2017)测试hepcidin的抗炎作用在体外β淀粉样蛋白的主要文化(Aβ)激活星形胶质细胞和小胶质细胞,以及Aβ-intoxicated小鼠模型,并发现hepcidin会使炎症和氧化剂过程引起Aβ保护邻近的神经元。炎症和氧化应激在阿尔茨海默病的发病机制有重要的角色,这些互补的在体外和在活的有机体内发现可能指向一个新的阿尔茨海默病的治疗策略。
结论
神经退行性疾病严重的健康和全球经济挑战。继续推进研究和药物发现因此强制如果我们要应对这些挑战,提高生活质量每年数以百万计的患者影响。
虽然传统在活的有机体内研究利用动物模型在阐明价值的星形胶质细胞和小胶质细胞在神经退行性疾病的作用,这些往往缺乏对人类生理相关性和翻译,并能因此提高临床试验的风险和成本提供误导的结果。
新在体外细胞培养方法,比如主要人类细胞的三维培养模拟更准确在活的有机体内因此,多细胞环境可以补充甚至取代在活的有机体内使用动物模型研究。当前的研究表明这些新在体外方法是可行的,有可能确定新的治疗途径改善,甚至拯救,许多病人的生命。
引用:
1。组织WH。神经障碍:公共卫生挑战[网络]。2006年。可以从http://www.who.int/mental_health/neurology/neurological_disorders_report_web.pdf
2。Maragakis N, Rothstein j .疾病的机制:星形胶质细胞在神经退行性疾病。Nat Pract。2006; 2:679 - 89。
3所示。报摊M, Butovsky o .在中枢神经系统小神经胶质细胞功能健康和神经退化。为Immunol。2017; 35:441 - 68。
4所示。克拉克Liddelow年代,Guttenplan K, L,贝内特F波伦C, Schirmer L, et al。神经毒性反应性星形胶质细胞活化的小胶质细胞引起的。大自然。2017;541:481-7。
5。块,Zecca L,香港j . Microglia-mediated神经毒性:揭露的分子机制。Nat转速> 57分2007;69年。
6。Lobsiger C,克利夫兰d non-cell-autonomous神经退行性疾病的神经胶质细胞内在组件。Nat > 2007; 10:1355-60。
7所示。Liberatore G, Jackson-Lewis V, Vukosavic年代,寺庙,维拉米,麦考利夫W, et al。一氧化氮合酶注射刺激多巴胺能神经退化的MPTP药物诱导的帕金森病模型。Nat方法。1999;5:1403-9。
8。Elgueta D, Aymerich M,孔特雷拉斯F,蒙托亚,Celorrio M, Rojo-Bustamante大肠药物多巴胺D3受体拮抗作用变弱神经退化和运动障碍的帕金森病小鼠模型。神经药理学。2017;113:110 - 123。
9。Calvello R, Cianciulli Nicolardi G·德·Nuccio F, Giannotti L,萨尔瓦多·R .维生素D治疗变弱神经炎症和多巴胺能神经退化帕金森病动物模型,将M1, M2小胶质细胞反应。J神经免疫杂志。2017;12:327-39。
10。凯蒂r .如何神经炎症导致神经退化。科学(80 -)。2016;353:777 - 83。
11。李张ph, Haidet-Philips,范教授J, Y, Y霍,Tienari P, et al .代GFAP: GFP星形胶质细胞记者从成人行fibroblast-derived使用锌指核酸酶技术“诱导多能性”细胞。神经胶质。2015;64:63 - 75。
12。Efremova L, Chovancova P,亚当M, Gutbier年代,Schildknecht年代,Leist M .从星形神经保护转向由细胞因子刺激神经退化。拱Toxicol。2017; 91:231-46。

