Ras通路与癌症:调控、挑战和治疗进展

多年来,Ras信号通路引发了癌症研究领域的希望和挫折。在正常的健康状况下,Ras信号通路对细胞增殖、生长和存活所涉及的细胞内信号网络的调节至关重要。然而,像许多细胞信号通路一样,与ras相关的级联也有黑暗的一面。基因突变拉基因本身,或在上游或下游的调控因子中,可以推动该途径进入一种构成性活跃的、诱发癌症的状态。
在最近对主要癌症突变数据库的分析中,估计约19%的癌症患者患有癌症拉突变——相当于全球每年新增340万例癌症病例。1因此,找到抑制异常Ras信号的方法仍然是一个关键的研究重点。2
Ras信号通路是什么?
H-Ras、K-Ras和N-Ras是密切相关的蛋白质,在人类癌症中经常发生突变。具体来说,它们是小的鸟苷三磷酸酶(GTPases)的不同异构体,在所有哺乳动物细胞中起二元开关的作用。通常,Ras蛋白是被严格控制的,在活性(结合到鸟苷三磷酸,GTP)和非活性状态(结合到鸟苷二磷酸,GDP)之间切换。当“打开”时,它们会触发一个复杂的信号级联,转导细胞生存和生长信号。 3. 虽然Ras功能在许多水平上受到调控,但核心通路包括Ras、Raf(快速加速纤维肉瘤)、MEK(丝分裂原激活的细胞外信号调节激酶)和ERK1/2(细胞外信号相关激酶1和2)。通常被称为Ras-Raf-MEK- erk级联(图1),它是一个中心的、进化保守的通路,通过以下序列将信号从细胞表面受体传递到下游的转录因子靶点 : 3.
- 表皮生长因子(EGF)与EGF受体的结合激活了鸟嘌呤交换因子(如SOS),使Ras携带GTP。
- Ras-GTP将Raf或Raf/MEK异二聚体招募到质膜上。
- RAF - mek组件激活RAF。
- 活性Raf二聚体激活MEK。
- 激活的MEKs磷酸化ERKs(丝裂原激活蛋白激酶的一个亚组,MAPK)。
- ERK磷酸化多种底物,参与细胞增殖、生存、生长、代谢、迁移和分化。
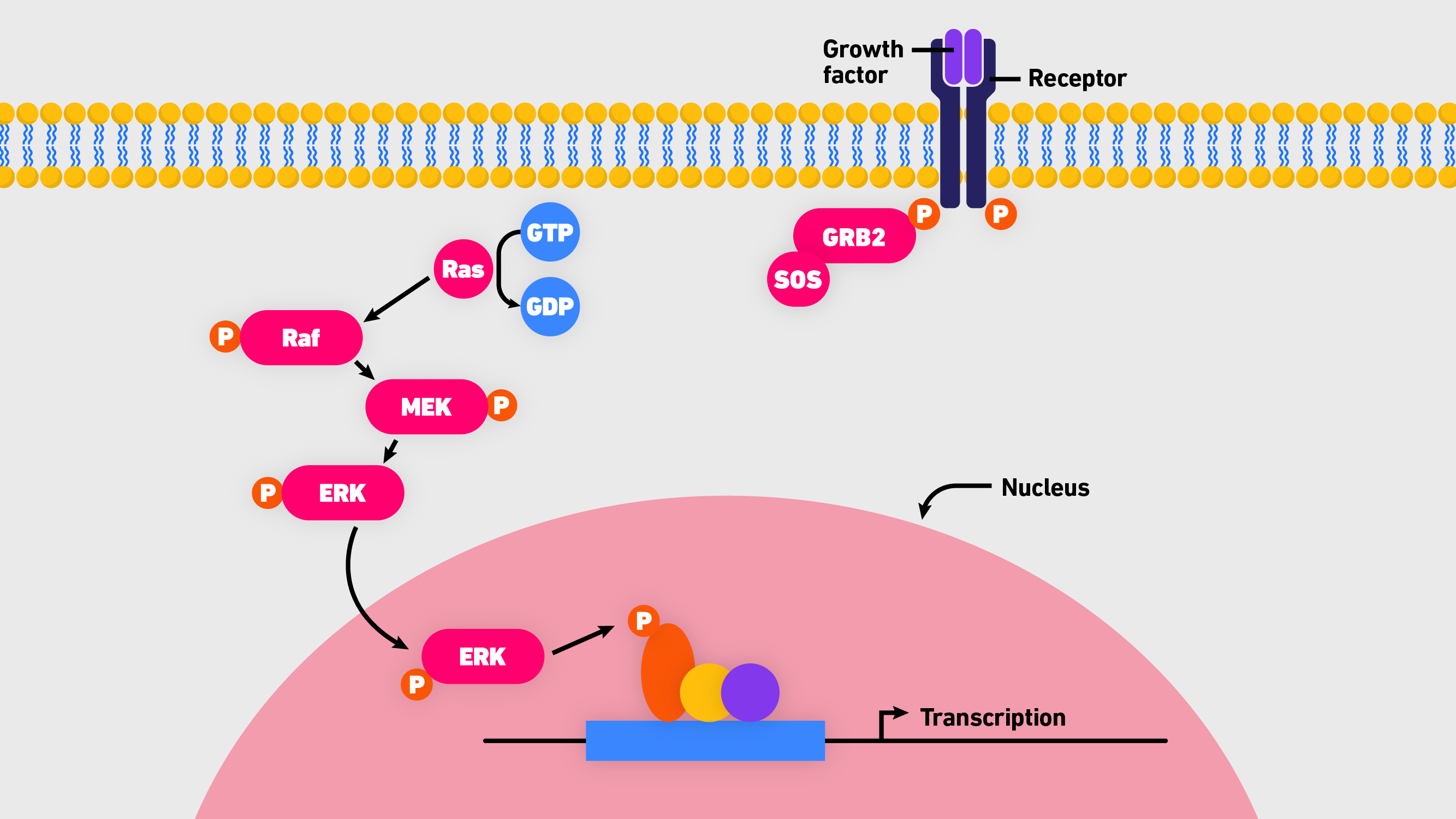
图1:的概述Ras-Raf-MEK-ERK级联。
Ras-Raf-MEK-ERK级联是一个复杂的途径——不仅因为它充满了首字母缩略词。一个术语通常用来表示多个异构体;Ras和Raf各有三种异构体,MEK可以以MEK1或MEK2的形式存在,ERK则是指ERK1和ERK2。4,5,6Ras信号通路的调控也很复杂;除了EGF,还有其他受体酪氨酸激酶(rtk)能够影响通路。“由于反馈存在于多个层面,细胞可以绕过或选择额外的突变来获得耐药性,”他说玛丽·帕森斯他是威尔康奈尔医学院的医学博士后。下游,ERK调控250多种底物,包括转录因子、蛋白激酶和磷酸酶、细胞骨架元素和凋亡调节因子。7
Ras信号是如何失调并导致癌症的?
当Ras开关永久“打开”时,产生的本构信号提供了使肿瘤发生成为可能的增殖信号。这种构成状态可能是由编码途径中关键蛋白质的基因突变造成的,包括Ras本身。“网络的解除管制最常通过激活Ras或RTK-Ras信号通路的突变发生。玛丽娜Pajic他是加文医学研究所个性化癌症治疗实验室的副教授和实验室负责人。Pajic指的是癌症基因组学cBioPortal和癌症基因组图谱(TCGA),这两者都是大规模癌症基因组学数据集的家,能够识别和量化模式。例如,一项基于tcga的研究表明,RTK-Ras通路在所有癌症类型中具有最高的中位突变频率,在高达46%的人类癌症中发现了突变。8
拉基因是人类癌症中最常突变的基因之一,通常与密码子12、13或61上的单个突变相关,所有这些都有利于活性(gtp结合)Ras的形成。9,10尽管具有相似的功能后果,但并非所有Ras突变体都是相同的,并且发生频率不同:K-Ras是主要突变亚型(85%),其次是N-Ras(11%)。11“在某些癌症中,如胰腺导管腺癌(PDAC),突变激活的K-Ras是最常见的改变。当我们12,13,14和其他人15突变激活了吗喀斯特在94%的病例中发现,是治疗耐药性的主要原因,”Pajic说。与此同时,国家管制当局方面突变在黑色素瘤中占主导地位。16,17作为拉帕森斯解释说:“例如,EGFR抑制剂通常对黑色素瘤比结肠直肠癌更有效,结肠直肠癌可以用其他突变因素来解释。”
而拉突变是最常见的,改变也可以发生在途径的不同或多个阶段;大约60%的非小细胞肺癌有“驱动癌基因”的改变,包括表皮生长因子受体,BRAF而且喀斯特.18同时,90%的胰腺癌与喀斯特突变,19大多数甲状腺癌都是拉或BRAF突变体。20.总的来说,组成性活跃的Ras-Raf-MEK-ERK通路可以导致不同的结果,因为该通路控制着与细胞生长、迁移、存活和细胞周期相关的遗传程序。21
与靶向Ras途径相关的困难
目前,还没有针对Ras突变型癌症专门设计的有效治疗方法。缺乏临床成功,加上针对该途径的臭名昭著的困难,导致Ras成为“不可药物”的靶标。虽然“难以下药”的头衔现在正受到挑战,但关键的障碍和复杂性仍然存在 : 22 , 23
- Ras的拓扑结构不适合高亲和力药物的设计,因为它缺乏一个可接近的口袋。
- 突变蛋白几乎与基本的野生蛋白完全相同。
- 野生型Ras亚型可以与致癌Ras蛋白相互作用,显示出促进肿瘤和抑制肿瘤的功能。
Pajic说:“这一途径很难靶向,特别是由于细胞能够快速克服封锁,并通过下游或并行机制重新激活信号。”帕森斯补充说:“虽然已经努力开发小分子抑制剂(其中一些已经在临床应用),但它们经常遇到阻力,即使在抑制剂存在的情况下,细胞也会不断找到诱导信号传递的方法。很多抑制剂在患者中也会有不同的反应。”
丢掉“无法下药”的标签:ras靶向治疗的最近成功和发展
在经历了漫长的挫折之后, 最近成功 在这个领域产生了新的能量。有希望的II期结果观察到KRASG12C在先前治疗过的晚期非小细胞肺癌患者中,一种名为sotorasib/AMG 510的抑制剂导致了快速和持久的肿瘤收缩。 24 帕森斯说:“现在我们已经看到它是可能的,我认为许多改进这种抑制剂的努力将正在进行中。12C抑制剂并不完美,论文已经显示了耐药性,但我认为基本概念将为改进抑制剂的发展打开大门,提高疗效。公司目前对这一信息保密,但我认为许多公司会在初步发现的基础上进一步发展。”这种小分子药物就是第一个KRASG12C在细胞系和患者来源的异种移植模型中,该抑制剂已被证明可以抑制KRAS信号通路和肿瘤生长。 25
随着细胞发现产生耐药性的新途径,研究人员开始寻找新的工具和方法——通常不仅仅是单一的解决方案。例如,在黑色素瘤中使用MEK抑制剂和BRAF抑制剂已被证明可以减缓耐药性的获得。 26 Pajic指出了其他一些进展,包括临床级的生产 “iExosomes”(含KrasG12D siRNA的间充质基质细胞来源的外泌体) 以及KRAS效应器的靶向,如PTPN11在晚期实体癌患者(例如, NCT04528836 , NCT04252339 ). 27 帕森和他的同事们也在探索一系列临床前模型的联合疗法,并描述了KRAS如何12 c抑制剂和EGFR抑制剂导致细胞死亡体外。 28
ras靶向治疗的一些新方法涉及最初被认为不成功的化合物的复活。Raf-MEK抑制剂CH5126766的开发最初看起来很有前景,但因毒性问题而受阻。为了探索潜在的限制毒性的方法,该抑制剂在I期研究中采用间歇给药计划。 29 总的来说,我们得出的结论是,在多种癌症类型中都实现了抗肿瘤活性,并且该抑制剂被认为是可耐受的,因此需要进一步评估Raf-MEK抑制剂。
持久的、创造性的思维是这个领域所需要的,这也是Pajic所需要的 阿里巴巴的团队正在努力实现这一目标。通过探索的使用 新型小分子间质靶向药物Pajic希望在原发肿瘤和转移肿瘤中剥夺癌细胞的支持间质龛,同时支持化疗和/或免疫肿瘤药物。 30. , 31
需要精确、新颖的肿瘤学工具和临床前模型来推动ras相关疗法的发展。对于帕森斯来说,她的任务是开发出更有代表性的结直肠癌动物模型,因为目前许多模型在小肠中形成肿瘤。与此同时,同事和合著者Maria Zafra正在使用碱基编辑对特定的小鼠进行明显的改变喀斯特突变-现在发表在癌症的发现: 28 “小鼠和随后的类器官培养是一个非常有价值的工具,可以忠实地概括信号动力学,并作为重要的临床前模型。以前,大多数研究将使用细胞系,这消除了很多信号的复杂性,”帕森斯说。在同一实验室中,开发了一个报告器,用于指示何时发生精确的、可诱导的碱基编辑。帕森斯解释说:“这将是非常令人兴奋的,因为你可以引入一个特定的突变,然后“关闭”传递系统,以避免长期或脱靶效应。”这项工作为实现CRISPR碱基编辑在细胞系、类器官和动物模型中产生靶向突变打开了大门。 32
来自KRASG12C抑制剂突破到联合疗法的探索,ras相关研究已经取得了重大进展。总之,临床前研究工具,如碱基编辑报告器、类器官和精确的动物模型,正在为开发合理的、量身定制的抗癌策略铺平道路。
帕森斯说:“除此之外,我认为基因工程领域总体上推动了这一领域的发展。”“开发临床前模型的方式正在迅速改变,以制作更具代表性的模型。我们在类器官中诱导突变的方式正在发生变化,CRISPR/碱基编辑领域正在以如此快速的速度发展。许多公司在药物设计和现有药物(如12C抑制剂)的基础上也变得越来越聪明。”
参考文献
1.前IA, Hood FE, Hartley JL。Ras基因在癌症中的突变频率。癌症Res.2020; 80(14): 2969 - 2974。doi:0008 - 5472. - 10.1158 / - 19 - 3682
2.戈布里勒IM,阿德杰AA。Ras癌基因抑制剂作为治疗靶点。美国北部血液病医院.2002; 16(5): 1065 - 1088。doi:10.1016 / s0889 - 8588 (02) 00050 - 3
3.张飞,李俊杰,等。Ras/Raf/MEK/ERK通路介导的细胞因子受体到转录因子的信号转导:治疗干预的潜在靶点白血病.2003; 17(7): 1263 - 1293。doi:10.1038 / sj.leu.2402945
4.Rebocho AP, Marais R. ARAF作为稳定BRAF的支架:CRAF异二聚体。致癌基因.2013年,32(26):3207 - 3212。doi:10.1038 / onc.2012.330
5.Caunt CJ, Sale MJ, Smith PD, Cook SJ。MEK1和MEK2抑制剂和癌症治疗:漫长而曲折的道路。Nat Rev癌症.2015; 15(10): 577 - 592。doi:10.1038 / nrc4000
6.Buscà R, Pouysségur J, Lenormand P. ERK1和ERK2 MAP激酶:特定的角色或功能冗余?前端细胞开发生物学.2016; 4。doi:10.3389 / fcell.2016.00053
7.Yoon S, Seger R.细胞外信号调节激酶:多种底物调节不同的细胞功能。生长因子.24(1): 2006; 21-44。doi:10.1080 / 02699050500284218
8.王志强,王志强,等。癌症基因组图谱中的致癌信号通路。细胞.2018, 173 (2): 321 - 337. - e10。doi:10.1016 / j.cell.2018.03.035
9.Scott AJ, Lieu CH, Messersmith WA。RAS突变的治疗方法。癌症杂志.2016; 22(3): 165 - 174。doi:10.1097 / PPO.0000000000000187
10.在发育和癌症中的特异Ras功能。未来的杂志.2009; 5(1): 105 - 116。doi:10.2217 / 14796694.5.1.105
11.霍伯杰,德CJ,罗斯曼KL. RAS亚型与癌症突变的研究。细胞科学.2016, 129(7): 1287 - 1292。doi:10.1242 / jcs.182873
12.张德华,张德华,等。基因组分析确定了胰腺癌的分子亚型。自然.2016, 531(7592): 47-52。doi:10.1038 / nature16965
13.王志强,王志强,等。全基因组重新定义胰腺癌的突变格局。自然.2015, 518(7540): 495 - 501。doi:10.1038 / nature14169
14.王晓明,王晓明,等。胰腺癌基因组揭示了轴突引导通路基因的畸变。自然.2012, 491(7424): 399 - 405。doi:10.1038 / nature11547
15.张晓东,张晓东,张晓东,等。全球基因组分析揭示人类胰腺癌的核心信号通路。科学.2008, 321(5897): 1801 - 1806。doi:10.1126 / science.1164368
16.斯托纳克CA,德CJ。RAS,死活通缉:靶向RAS突变癌症的进展。Sci的信号.2020; 13 (624): eaay6013。doi:10.1126 / scisignal.aay6013
17.Cox AD, Fesik SW, Kimmelman AC, Luo J, Der CJ。给不可药的RAS下药:可能的任务?Nat Rev药物发现.2014; 13(11): 828 - 851。doi:10.1038 / nrd4389
18.扎曼,吴,比沃娜。靶向致癌性BRAF:过去、现在和未来癌症.2019; 11(8): 1197。doi:10.3390 / cancers11081197
19.王平,王志强。快照:tcga分析的肿瘤。细胞.2018年,173(2):530。doi:10.1016 / j.cell.2018.03.059
20.癌症基因组图谱研究网络。甲状腺乳头状癌的整合基因组特征。细胞.2014; 159:676 - 690。doi:10.1016 / j.cell.2014.09.050
21.Gimple RC, Wang X. RAS:攻击致癌电路的核心。前肿瘤防治杂志.2019; 9:965。doi:10.3389 / fonc.2019.00965
22.McCormick F.直接针对KRAS。癌症生物学年鉴.2018; 8:81 - 90。doi:10.1146 / annurev - cancerbio - 050216 - 122010
23.周b, Der CJ, Cox AD。野生型RAS亚型在癌症中的作用。Semin细胞发育生物学.2016; 58:60 - 69。doi:10.1016 / j.semcdb.2016.07.012
24.洪德昌,王志强,王志强,等。喀斯特G12Csotorasib对晚期实体瘤的抑制作用。N英语J医学.2020; 383(13): 1207 - 1217。doi:10.1056 / NEJMoa1917239
25.贾佳良,王志刚,等。临床KRAS(G12C)抑制剂AMG 510驱动抗肿瘤免疫。自然.2019, 575(7781): 217 - 223。doi:10.1038 / s41586 - 019 - 1694 - 1
26.Eroglu Z, Ribas A. BRAF和MEK抑制剂联合治疗黑色素瘤:最新证据和治疗位置。医生医生.2016; 8(1): 48-56。doi:10.1177 / 1758834015616934
27.刘志刚,王志刚,王志刚,等。kras驱动的突变癌症依赖于PTPN11/SHP2磷酸酶。Nat地中海.2018; 24(7): 954 - 960。doi:10.1038 / s41591 - 018 - 0024 - 8
28.Zafra MP, Parsons MJ, Kim J,等。一个体内Kras等位基因序列揭示了常见致癌变异的不同表型。癌症越是加大.2020; 10(11): 1654 - 1671。doi:2159 - 8290. - 10.1158 / cd - 20 - 0442
29.郭晨,Chénard-Poirier M,罗达D,等。口服RAF-MEK抑制剂CH5126766/VS-6766在RAS/ raf突变实体瘤和多发性骨髓瘤患者中的间歇性计划:一项单中心、开放标签、一期剂量增加和篮子剂量扩大研究。《柳叶刀》杂志.2020; 21(11): 1478 - 1488。doi:10.1016 / s1470 - 2045 (20) 30464 - 2
30.李志强,李志强,李志强,等。肿瘤微环境中Src信号通路的研究进展:从机制到治疗。2月J.2019; 286(18): 3510 - 3539。doi:10.1111 / febs.15011
31.李文敏,李文敏,李文敏,李文敏,李文敏。肿瘤间质对胰腺癌治疗的影响。胃肠病学.2018, 154(4): 820 - 838。doi:10.1053 / j.gastro.2017.11.280
32.张晓明,张晓明,张晓明,等。GO:功能报告系统,识别和丰富基地编辑活动。核酸测定.2020年,48(6):2841 - 2852。doi:10.1093 / nar / gkaa124



