细胞培养基础:设备,基础和协议

刚接触细胞培养?那就不要再看了。在这里,您将了解细胞培养的基本概况,从建立细胞培养实验室到了解基本原理和基本技术。这是进入细胞生物学世界的一个很好的起点。
细胞培养所需的基本设备和试剂
细胞培养实验室设计
细胞培养安全性
细胞培养基础知识
-培养条件
-原代细胞与永生细胞
-粘附培养vs悬浮培养
-哺乳动物与非哺乳动物文化
-细胞生长和融合
-选择手机线路
- Cell line认证
-细胞培养基:为您的细胞选择合适的培养基
标准细胞培养方案
-无菌技术
-初级细胞分离
-传代传代细胞
-低温保存和解冻
-检测细胞支原体感染
-单元格计数
-细胞转染
什么是细胞培养?
细胞培养是指从动物或植物中提取细胞,然后在人工环境中培养用于科学研究。第一个细胞培养技术是在100多年前开发出来的,从那时起,它为科学的巨大突破做出了贡献。今天,它是一个基本工具在世界各地的实验室中用于研究细胞的正常生理和生物化学,疾病机制,包括癌症,以及药物还有有毒化合物。它也用于药物筛选与开发ent以及大规模生产生物化合物,如疫苗和治疗性蛋白质.1,2细胞培养在食品工业中的作用也越来越大污染物检测而在细胞农业而且非养殖肉生产以减轻环境负担。
细胞培养所需的基本设备和试剂
为了进行需要细胞培养工作的研究和执行基本的细胞培养协议,需要几件关键设备和一些基本试剂,总结在表1和表2中。
表1:细胞培养所需的基本设备。3.,4,5这些图片是由BioRender.com创建的。

完全培养基
|
请参阅下面关于单元格介质的部分。 |
|
缓冲溶液
|
用于清洗电池的磷酸盐缓冲盐水(PBS)。 |
|
分离剂
|
从培养容器中分离粘附细胞的酶,如胰蛋白酶 |
|
冷冻保存剂 |
一个代理人降低介质的冰点,减慢冷却速度,以减少形成冰晶的风险,从而损害细胞并导致细胞死亡。二甲基亚砜(DMSO)是最常用的。 |
去离子水和蒸馏水以及冰也很重要。所要进行的实验的性质将告知需要获得的试剂。
细胞培养实验室设计
任何细胞培养设置都需要几个重要的设计考虑因素。最重要的方面是使用设计要保持无菌和无菌的环境防止细胞污染.首先,应使用单独的封闭房间或实验室,只有一个进出点。在进出实验室时,洗手槽应放置肥皂和消毒剂,便于洗手。专用的细胞培养实验室外套和安全护目镜应存放在实验室入口。层流罩和培养箱应远离入口,以减少污染风险。同样重要的是,通风柜和培养箱的位置远离任何空调机组,以防止潜在的污染气流进入无菌的工作环境和培养箱。应该有足够的清洁工作台面,需要定期消毒,并有足够的存储空间,以确保表面保持清洁。所有必要的设备和消耗品应在实验室内便于接触,防止进出。符合人体工程学的环境对层流罩很重要,在工作时要有足够的空间放置抽屉或可移动的消耗品手推车,并且易于接近培养箱,显微镜和离心机.6使用合适的塑料消耗品也很重要将可提取化合物浸出的风险降至最低污染你的细胞培养。
细胞培养安全性
细胞培养实验室在处理和操作细胞和组织以及有毒、腐蚀性或致突变溶剂和试剂方面存在风险。因此,遵守标准微生物实践和技术对于始终降低风险和确保安全至关重要。生物安全安全有四个上升的等级,称为生物安全级别(声波测井)。在处理危险生物材料和制剂时,每个级别都有标准的微生物实践、安全设备和设施保障措施。BSL-1是大多数研究和临床实验室普遍采用的基本保护级别,在这些实验室中,所使用的制剂不知道会在正常健康的人体中引起疾病。BSL-2适用于已知可通过摄入或经皮或粘膜暴露引起不同严重程度人类疾病的中等风险药物。大多数细胞培养实验室至少应该是BSL-2级,但确切的要求取决于所使用的生物材料和所进行的工作类型。BSL-3用于造成严重和可能致命感染的病原体,BSL-4是最高级别的遏制级别,用于处理对个人造成威胁生命疾病高风险的感染病原体的实验室。4,7
以下是细胞培养实验室的基本安全建议。该清单绝不是完整的,应补充适当的生物安全级别建议。
始终穿戴适当的个人防护装备(PPE),包括实验室外套、手套和安全护目镜。
始终阅读您正在处理的任何物质的材料安全数据表(MSDS),以确保在处理时采取适当的安全措施。
-在实验前后对所有工作表面进行消毒。
-定期清洁实验室设备,即使它没有被污染。
-避免产生气溶胶和/或飞溅。
-在接触潜在危险物质后和离开实验室前洗手。
-在处置所有可能具有传染性的材料前进行消毒。
-向相关人员(如实验室主管、安全员)报告任何可能导致接触感染性物质的事件。
-请勿在实验室内进食、饮水、吸烟、触摸隐形眼镜、使用化妆品或储存供人食用的食物。
细胞培养基础知识
培养条件
为了细胞的生存和增殖,培养环境尽可能地复制细胞的生理环境是至关重要的。可控制的培养条件包括温度、相对湿度和CO2以及与培养基相关的因素,如营养成分、pH值、渗透压和补充的量和频率。这些变量会随着时间的推移而波动,所以应该如此监控.表3列出了大多数哺乳动物细胞培养的最佳培养条件,但也存在例外情况。5
pH值
|
7.0 - -7.4
|
|
渗透性
|
280 - 320 mOsmol /公斤 |
|
有限公司2
|
5 - 10%
|
|
温度 |
35-37◦C
|
原代细胞与永生化细胞
原代细胞培养是直接从完整或游离的组织或器官碎片中分离出来并在培养皿中培养的细胞。一旦原代培养第一次被继代培养,它就被称为细胞系。原代细胞系的寿命是有限的,在达到衰老(细胞分裂停止)状态之前只能进行10-20次传代培养。1
有些细胞系的寿命没有限制,并且有无限的增殖能力。这些细胞系被称为连续的或永生细胞系.细胞的永生化可以通过多种方式发生。癌细胞具有固有的突变,使细胞在培养中不受限制地繁殖。最初寿命有限的正常细胞可以通过生长促进基因的突变转化为永生细胞。在培养物中生长的正常细胞也可以通过化学物质处理或引入激活生长促进基因的致癌病毒来有意地使其永生。图1显示了原代到转化连续细胞系的演变以及每个阶段的理论细胞产量。9
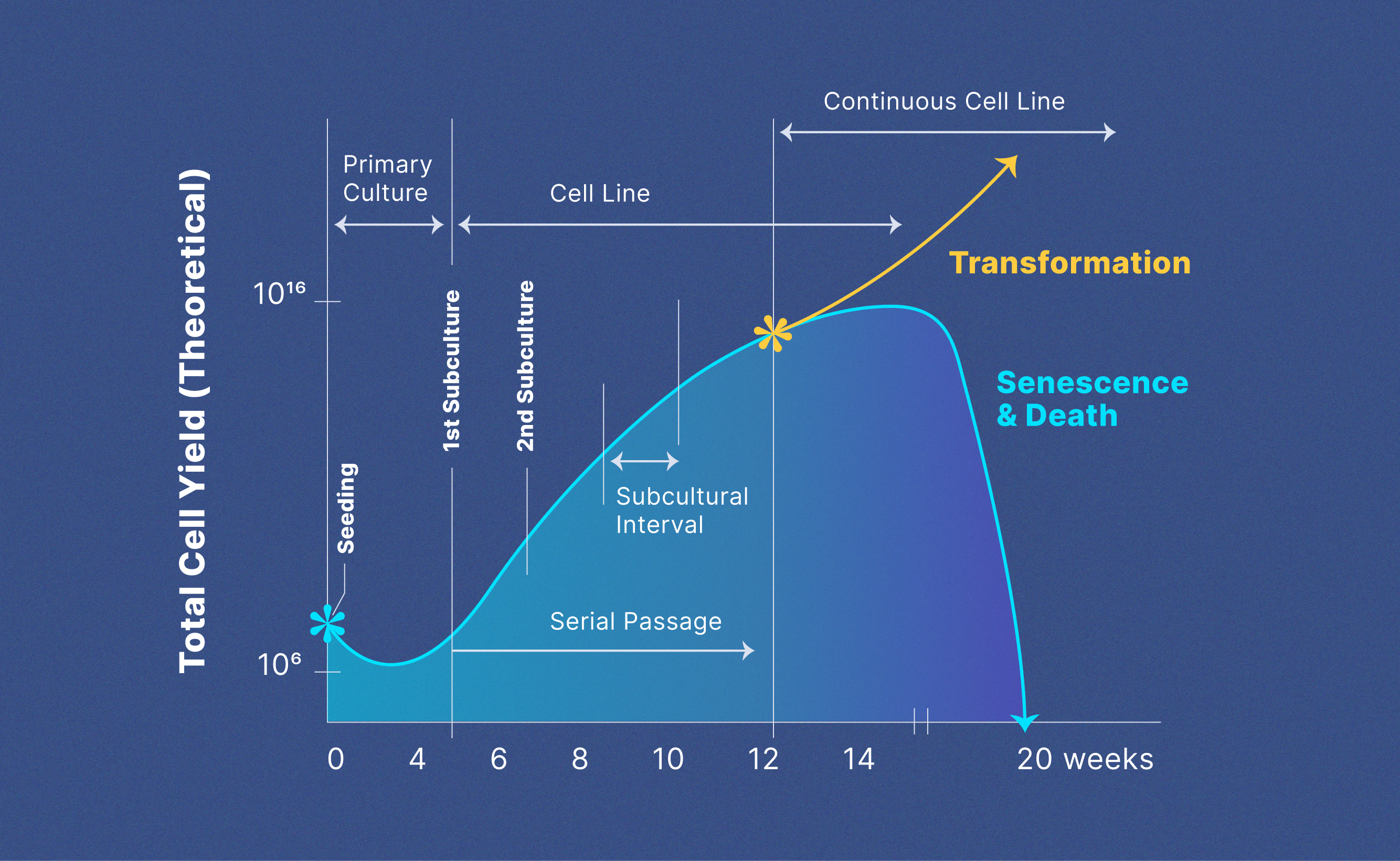
图1: 原代细胞系到连续细胞系的进化和理论细胞产量。
粘附培养与悬浮培养
贴壁细胞单层生长,附着在细胞培养容器表面。当通过时,需要使用分离剂将它们从表面分离。它们在电镀后几小时内重新附着在表面上。悬浮细胞在细胞培养容器表面不形成单层,而是保持悬浮状态。细胞形成团块,特别是在高密度时。1,10
哺乳动物与非哺乳动物文化
哺乳动物细胞培养是最常见的,然而,来自大量生物的细胞也可以培养,如植物、昆虫、细菌和酵母。植物细胞培养通常在液体培养基上以细胞悬浮培养或在固体培养基上以愈伤组织培养方式培养。细胞来源于黑腹果蝇或粘虫Spodoptera frugiperda是分别用于生化分析或重组蛋白表达的昆虫细胞系的例子。对于细菌和酵母,少量的细胞通常是在含有营养物质的固体载体上培养的,通常是琼脂等凝胶,而大规模的培养则是在营养肉汤中悬浮细胞。
细胞生长和融合
细胞培养生长通常发生在四个阶段(图2)。滞后期发生在细胞适应培养条件并且不分裂的时候。Log期发生在细胞活跃分裂时。这是细胞实验和数据收集的最佳阶段。当细胞达到后期对数期时,应进行传代培养。这发生在过度拥挤之前。当细胞接近过度拥挤时,细胞生长就会减慢。这被称为固定相或平台相。这个阶段的细胞面临着细胞应激的风险。当细胞死亡的自然过程占主导地位时,一个细胞群被认为处于死亡阶段,也称为衰退阶段。当将细胞计数随时间的对数绘制成图形时,它会生成如图2所示的s型曲线。 It is important to note that the amount of time spent in each phase differs between individual cell lines and cultures.11

图2: 细胞生长的四个阶段。
描述单层细胞培养的一个重要指标是汇合度。它是在显微镜下观察时被一层细胞覆盖的培养血管表面积的百分比。例如,当培养容器的一半表面积被细胞覆盖时,种群被认为是50%合流。图3中的示意图显示了不同单元汇流的示例。细胞密度用来描述在悬浮液中生长的细胞。2,5

图3: 在显微镜下显示细胞在20%、50%、80%和100%汇合时的4个视场的示意图。这张图片是由BioRender.com创建的。
选择细胞系
在世界各地的实验室中,有数千种已建立的细胞系,可以从商业或非营利供应商(细胞库)处购买。从信誉良好的供应商获得细胞系是至关重要的,因为细胞是经过验证和无污染的。从其他实验室获取细胞系有很高的污染风险,缺乏细胞系验证,因此建议不要这样做。
应考虑表4中的标准选择合适的细胞系为了一个实验。选择的细胞系将在很大程度上取决于要进行的实验的性质和要求。
物种
|
需要使用特定物种的细胞系吗?如果不是,非人类和非灵长类细胞系通常需要减少生物安全限制,这可能是有利的。 |
|
功能特征
|
使用合适的细胞系进行实验。例如,肝和肾来源的细胞系可能更适合进行毒性测试。 |
|
有限的或不朽的
|
有限细胞系的功能更相关,因为它们没有经历永生,但永生细胞系往往更容易维护和克隆。 |
|
普通型或变换型 |
转化后的细胞株生长速度加快,镀膜效率提高,但细胞发生了永久性的遗传变化。这会影响你的实验吗? |
|
生长条件及特点 |
生长率、克隆效率或饱和密度对你的实验重要吗?你需要的细胞是粘附的还是悬浮的?例如,如果你想表达一种高产量的重组蛋白,你会选择一种可以悬浮生长的快速生长细胞系。 |
表5列出了20种常用细胞系及其种类、组织来源和形态特征。细胞的形态通常被描述为成纤维细胞、上皮细胞或淋巴细胞,这表明细胞的起源和物理外观。成纤维细胞为双极或多极,形状细长;上皮细胞呈多边形形状,通常尺寸更规则;淋巴细胞呈球形,通常悬浮生长。1,5
表5:20种常用细胞系及其特性。
细胞系 |
起源 |
物种 |
形态 |
文化类型 |
子宫颈 |
人类 |
上皮 |
附着 |
|
胚胎肾 转化与 腺病毒 |
人类 |
上皮 |
附着 |
|
外周血 |
人类 |
淋巴母细胞 |
悬架 |
|
人类早幼粒细胞 白血病细胞 |
人类 |
Lymphoblast-like |
悬架 |
|
乳腺癌 |
人类 |
Epithelial-like |
附着 |
|
骨 |
人类 |
上皮 |
附着 |
|
前列腺癌 |
人类 |
上皮 |
粘附,可适应悬挂 |
|
肺癌 |
人类 |
Epithelial-like |
附着 |
|
肝癌 |
人类 |
Epithelial-like |
附着 |
|
骨髓 |
人类 |
上皮 |
粘附或悬浮物 |
|
胚胎干细胞 |
人类 |
淋巴母细胞 |
悬架 |
|
卵巢的中国 |
仓鼠 |
上皮 |
附着 |
|
肾上皮细胞 |
非洲绿猴 |
上皮 |
附着 |
|
肾细胞 |
非洲绿猴 |
纤维母细胞 |
附着 |
|
纤维母细胞 |
鼠标 |
纤维母细胞 |
附着 |
|
纤维母细胞 |
叙利亚仓鼠 |
纤维母细胞 |
附着 |
|
上皮细胞 |
狗 |
上皮 |
附着 |
|
成肌细胞 |
老鼠 |
成肌细胞 |
附着 |
|
胚胎成纤维细胞 细胞 |
斑马鱼 |
纤维母细胞 |
附着 |
|
卵巢 |
秋粘虫(Spodoptera frugiperda) |
上皮 |
悬浮物或粘附物 |
Cell line认证
细胞培养是世界各地实验室的重要工具。然而,细胞系可能被错误识别或被其他细胞污染。这使已发表的数据无效,浪费实验室时间和资源。由于这一问题的严重性以及确保有效和可重复的结果的需要,期刊、机构和资助机构现在建议或要求Cell line认证.细胞系认证可以通过使用多态短串联重复序列(STR)位点的遗传分析来实现。在传代培养期间,应在收到新细胞系后定期对细胞进行鉴定。12
细胞培养基:为你的细胞选择合适的培养基
培养的细胞被喂食液体媒体.在为细胞配制培养基时,有四个关键因素需要考虑,如表6所示。您的细胞介质要求的具体细节可以在数据表中找到。培养新细胞系时,一定要检查培养条件的数据表细节。
基础培养基
|
基本培养基是营养物质和盐的混合物。有多种配方,包括最小必要介质(MEM), Dulbecco's modified Eagle 's medium (DMEM)和Roswell Park Memorial Institute (RPMI)。它们可以从商业渠道以液体形式或粉末形式购买。 |
|
谷氨酰胺
|
谷氨酰胺是细胞生长所必需的氨基酸。基础培养基可与谷氨酰胺一起购买,不含谷氨酰胺,或与稳定的二肽谷氨酰胺替代品。确保你的培养物在正常生长条件下含有谷氨酰胺是很重要的。 |
|
动物血清 |
细胞通常在补充了动物血清的基础培养基中生长。这就是所谓的“完整”介质。血清提供细胞所需的生长因子和营养物质。胎牛血清是最常用的。在大多数情况下,添加血清,使完整培养基混合物的最终体积在5%至20%之间。 |
|
抗生素 |
细胞培养基中经常添加青霉素和链霉素的抗生素组合,作为防止细菌生长的措施。有了无菌技术,就有可能在不使用抗生素的情况下培养健康的细胞。 |
标准细胞培养方案
有几个基本的细胞培养协议,在所有的细胞培养实验室执行。熟悉和理解这些协议非常重要。
无菌技术
无菌技术,如果坚持使用,可确保所有培养基和培养容器无菌,从而减少细胞接触的机会污染物保持文化的健康、活力和纯净。严格的无菌技术是细胞培养成功的必要前提,以保证培养物不受两者的影响微生物污染而且细胞交叉污染.无菌技术包括操作、试剂和工作场所,如表7所示。15,16
表7:细胞培养过程中无菌技术的概述。
处理 |
试剂/媒体
|
工作场所
|
·温柔细心的操作。
·开工前对所有物品进行消毒。
·无菌移液管,移液管头和塑料制品。
·禁止将无菌物品接触到未消毒的表面(包括戴手套的手接触自己的皮肤、衣服或头发)。 |
·所有试剂和设备的预灭菌。
·试剂中无可见污染。
·将试剂混合到较小的体积中进行工作,可以防止整个库存受到污染。
·拥有自己的工作库存可以消除共享库存的污染风险。 |
·检查培养罩是否正常工作。
·工作区域应保持无菌和整洁。
·经常清洗通风柜、恒温箱和冰箱。 |
初级细胞分离
原代细胞分离可以在各种复杂的生物样本上进行,包括组织(皮肤、肝脏、肿瘤、脑、肺等)、骨髓、血液、脾脏和淋巴结。有许多不同的方法来制备最佳的细胞分离样品。您选择的方法取决于您的起始样品,可能涉及从其中去除某些元素或简单地创建单细胞悬浮液。当从完整的组织中分离细胞时,必须首先使用机械力和/或蛋白水解酶破坏将细胞连接在一起的细胞外基质(表8)。 17
原代细胞分离的基本轮廓要求用无菌剪刀或手术刀将分离的组织切碎或切成2-4毫米的小块。将组织块添加到适当的缓冲液或平衡的盐溶液中,并清洗2-3次。根据方案添加解离酶并孵育。轻轻移液使细胞分散。细胞悬液通过细网过滤,清洗2-3次。细胞在培养基中重悬并播种。18
表8:用于细胞分离的组织分离方案中常用的酶。18
胶原酶
|
水解胶原蛋白,广泛用于从动物组织中分离细胞。 |
|
透明质酸酶
|
与胶原酶结合使用,催化1,4-β- d -糖苷键的水解。 |
|
DNase
|
添加到细胞悬浮液中,以减少由于受损细胞释放DNA而导致的细胞结块。 |
|
弹性蛋白酶
|
用于消化含有大量弹性蛋白的组织。 |
|
胰蛋白酶
|
一种对肽键具有特异性的丝氨酸蛋白酶,常与其他酶(如弹性酶和/或胶原酶)结合用于组织解离。 |
接种/使细胞
继代或传代是指稀释已达到高度合流的细胞,使其能够连续培养繁殖。贴壁细胞在80-90%融合时传代,悬浮培养在细胞开始结块和混浊时传代。记录每个细胞系的细胞传代数是很重要的。这有助于在原代细胞达到衰老之前监测其生存能力和计划实验。它有助于监测永生化细胞的年龄,因为传代数越高,遗传漂变越远。实验不应该在细胞系上进行 非常高的传代数 . 4
重要的是,在任何时候都要温和地处理细胞,因为剧烈或粗暴的处理会导致细胞损伤或死亡。不要将培养基或洗涤缓冲液直接移液到细胞上,要将其轻轻添加到血管一侧,以避免伤害细胞。当重新悬浮颗粒或搅拌混合细胞时,要轻轻进行。
简单地说,贴壁细胞的传代培养方案如下:去除培养基,用PBS清洗一次细胞。添加一种分离剂,如胰蛋白酶(分解使细胞粘附在血管上的蛋白质),并在37°C下培养细胞,直到它们完全分离。分离时间从1-20分钟不等,取决于细胞系。在显微镜下观察细胞以确定何时发生分离。通过向细胞中添加完整的培养基使胰蛋白酶失活(血清中含有蛋白酶抑制剂,使胰蛋白酶失活),并在细胞中旋转离心机(3-5分钟,150-300 x g)到颗粒细胞。除去培养基(液体在颗粒上),轻轻将细胞重悬在新鲜培养基中,并将细胞以所需密度装入新的培养容器中。对于悬浮细胞,不需要胰蛋白酶。收集细胞并离心(3-5分钟,150-300 x g)形成颗粒,去除培养基,细胞在PBS中重悬,进行洗涤步骤。在另一轮离心后取出缓冲液,细胞在新鲜介质中重悬,并以所需的密度重悬。5
低温保存和解冻
细胞系是宝贵的资源,因此保存细胞系进行长期储存是至关重要的。低温贮藏指的是在很低的温度下冷却和储存细胞以保持其活力的过程。细胞适合在-130°C以下的温度下长期储存。
最好的方法冷冻保存培养细胞是将它们储存在液氮的完全介质中,在低温保护剂(如DMSO)的存在下。防冷冻的代理降低介质的冰点,并允许较慢的冷却速度,大大降低了冰晶形成的风险,从而损害细胞并导致细胞死亡。细胞应在高浓度(如90%合流)下冷冻保存,并尽可能在最早的传代数下冷冻保存。简单地说,冷冻保存包括清洗和制粒细胞,用DMSO(例如,5% DMSO)在完整的培养基中重新悬浮,并将细胞悬液转移到1ml无菌冷冻瓶中。冷冻瓶被放置在一个控制速率的冷冻冰箱或冷冻容器中,因为细胞必须缓慢冷冻。冷冻冷冻容器在-50 ~ -80°C保存24小时,然后将冷冻瓶转移到液氮储存。2,8
确切的冷冻条件取决于所使用的细胞系。检查细胞系特定条件是非常重要的,否则你的冷冻储存在解冻和重新培养时可能无法产生活细胞。
来恢复细胞系从液氮存储,冷冻小瓶运输在便携式液氮容器或干冰到细胞培养区。冷冻瓶中的DMSO一旦被解冻,对细胞是有毒的,因此为了确保细胞的高存活率,细胞必须在37°C的水浴中迅速解冻,并立即转移到具有预热介质的培养皿中。介质稀释DMSO,使其不再处于有毒浓度。一旦解冻的细胞繁殖并传代两次,它们就可以用于实验。最好的做法是尽快冷冻更多的细胞,并更换从长期储存中取出的小瓶。2
检测细胞支原体感染
细胞培养的一个主要问题是支原体感染.这种细菌感染可以改变细胞的行为和代谢,并对细胞产生不利影响。定期进行支原体检测是非常重要的,特别是对于连续的细胞系。好的做法是,当收到新的细胞株时检测支原体,在冷冻之前解冻并培养,每4次- - - - - -培养细胞6周。一种简单可靠的检测支原体的方法是用Hoechst 33258(一种与DNA特异性结合的荧光染料)染色细胞样本,并在荧光显微镜下观察。无支原体细胞的核Hoechst染色清晰干净,而支原体感染细胞的细胞核外也显示丝状染色,即细菌DNA(图4)。5,19,20.
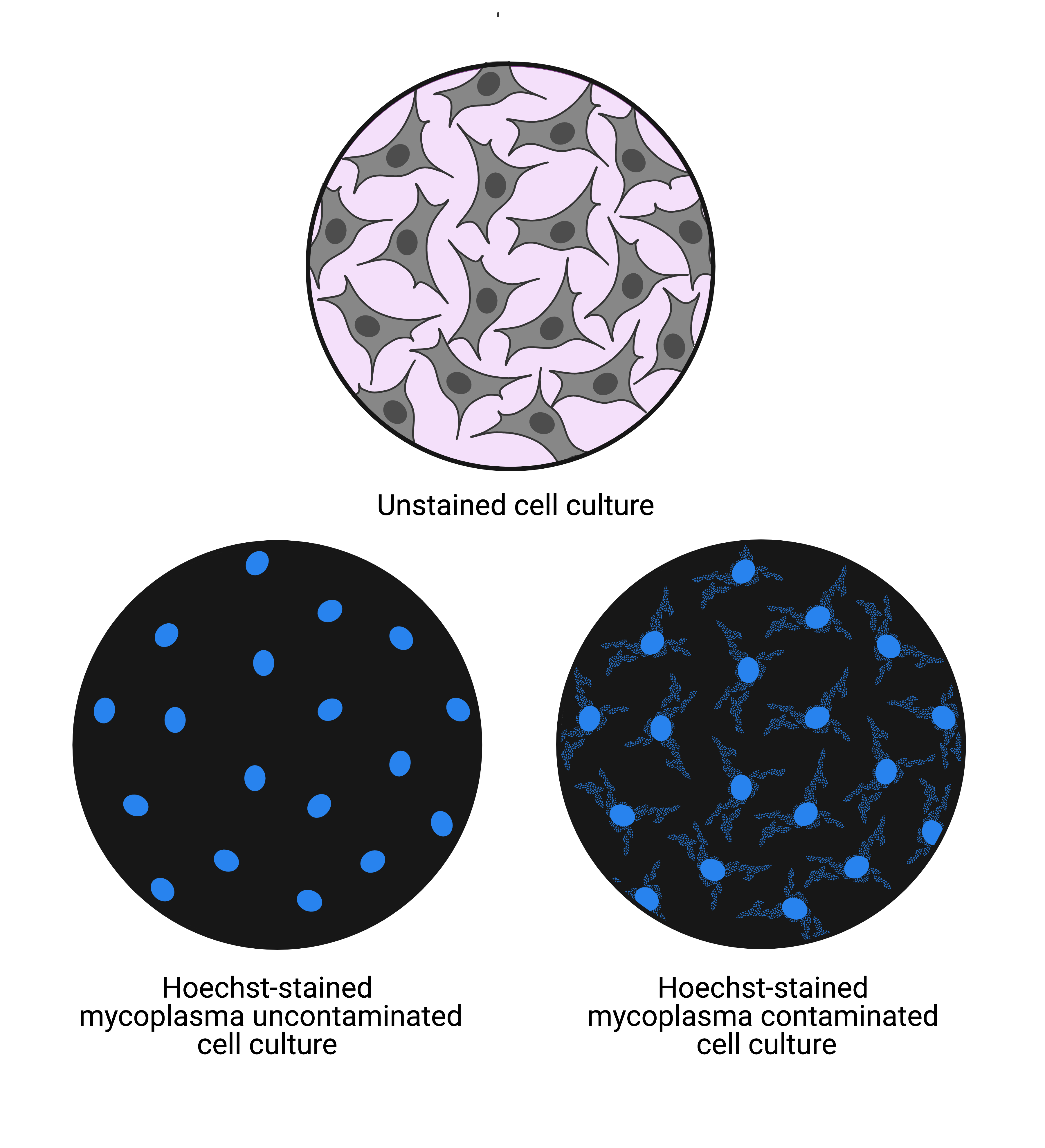
图4: 图中显示未染色的细胞(上)和用Hoechst 33258染色的未受支原体污染的细胞(左下)和受支原体污染的细胞(右下)的视场。未污染的细胞培养显示细胞核染色,污染的细胞培养显示细胞核染色和细胞质染色。细胞质染色显示存在支原体细菌DNA。 5 这张图片是由BioRender.com创建的。
细胞计数
尽管最近自动化细胞计数器的发展,手动细胞计数使用血细胞计仍然是最常用的方法。血细胞计由一个厚的玻璃载玻片组成,载玻片上有两个蚀刻的垂线网格形成腔室。还提供了一个薄玻璃罩。使用前一定要清洁血细胞计和盖上玻璃,并将盖上玻璃盖在室上。加10- - - - - -将20 μl细胞悬液滴入盖玻璃下显微镜载玻片上的两个腔中的一个。使用倒置相位对比显微镜在20倍放大率下计数在图5所示的四个外部方格中的每个细胞。你应该以数到100为目标- - - - - -200格每平方为准确的结果。如果你的细胞太少,那么下次用更少的介质重新悬挂你的细胞。如果你有太多的细胞数不清,那么将你的细胞重新悬挂在更高体积的介质中。一旦你数完每个角,把数加在一起,然后除以4。你的细胞浓度是你的计数x 104细胞/毫升。要计算出细胞总数,将浓度乘以细胞悬液体积。例如,5 mL浓度为80 x 10的细胞悬液4cell/mL为400 × 104单元格或4 × 106细胞或400万个细胞。4,5,21,22

图5: 用血细胞计计数细胞。顶部面板显示了血细胞计的空中和侧面示意图。左下角的面板显示了计数室在显微镜下的样子。红色方框突出显示要计算的象限。右下面板是如何在象限内计算单元格的示例。
细胞转染
细胞转染指核酸(DNA或RNA)进入培养细胞的过程。最常用的试剂是阳离子脂质,它可以与核酸结合形成带正电的复合物,并允许DNA/RNA与带负电的细胞膜相互作用。这导致核酸通过内吞作用有效进入细胞。这通常被称为脂质感染或脂质转染。另外,核酸可以通过电穿孔、DNA与磷酸钙共沉淀或聚brene/DMSO冲击传递到细胞中。传递的DNA通常不会在宿主基因组内整合,因此是短暂的。为了实现基因的稳定表达或敲除,可以设计稳定的细胞系。这需要DNA载体设计和抗生素选择的细胞DNA已经稳定地整合到基因组。23,24
脂质转染方案非常简单。从本质上讲,制备了含有正确浓度的DNA/RNA用于转染的溶液,并制备了含有该脂质体试剂的溶液。这两种溶液混合在一起,并根据协议培养一段时间。然后将溶液加入60- - - - - -80%融合细胞和实验早在转染后6小时即可进行。短暂转染通常持续72小时。25
参考文献
1.动物组织培养:原理与应用。动物生物技术:发现和翻译中的模型.爱思唯尔有限公司;2013:211 - 231。doi: 10.1016 / b978 - 0 - 12 - 416002 - 6.00012 - 2
2.约翰·M·戴维斯主编。动物细胞培养:基本方法.John Wiley & Sons有限公司;2011.https://www.wiley.com/en-us/Animal+Cell+Culture%3A+Essential+Methods-p-9780470666586
3.Clarke S, Dillon J.细胞培养实验室。动物细胞培养:基本方法.约翰·威利父子;2011:1-31。ch1 doi: 10.1002/9780470669815.
4.杨晓明,王晓明,王晓明。哺乳动物细胞培养。Curr Protoc Essent实验室技术.5(1): 4.3.1-4.3.32。2011;et0403s5 doi: 10.1002/9780470089941.
5.写明ATCC。动物细胞培养指南。2021年出版。https://www.atcc.org/ /媒体/ pdf /文化指南/ AnimCellCulture_Guide.ashx
6.莫里斯CB。细胞和组织培养实验室的规划和设计。细胞和组织培养的安全性.荷兰施普林格;1998:87 - 101。doi: 10.1007 / 978 - 94 - 011 - 4916 - 7 - _5
7.动物细胞培养处理的生物安全建议。施普林格;2015:689 - 716。doi: 10.1007 / 978 - 3 - 319 - 10320 - 4 - _22
8.沃纳DR,酒井D,桑德尔LL。哺乳动物细胞培养。Curr Protoc Essent实验室技术.2015; 10(1): 4.3.1-4.3.33。et0403s10 doi: 10.1002/9780470089941.
9.Stacey G, MacDonald C.原代细胞的永生。体外毒理学的细胞培养方法.荷兰施普林格;2001:27-42。doi: 10.1007 / 978 - 94 - 017 - 0996 - 5 - _3
10.莫顿噢。细胞培养的进展:锚定依赖性。Philos Trans R Soc B生物科学.2015, 370(1661): 20140040。doi: 10.1098 / rstb.2014.0040
11.Oyeleye OO, Ogundeji ST, Ola SI, Omitogun OG。动物细胞培养基础:现代科学的基础。生物技术Mol Biol Rev.2016; 11(2): -。doi: 10.5897 / bmbr2016.0261
12.马克思V.细胞系认证不再神秘。Nat方法.2014; 11(5): 483 - 488。doi: 10.1038 / nmeth.2932
13.姚涛,Asayama Y.动物细胞培养基:历史,特点和当前问题。重制医学生物学.2017年,16(2):99 - 117。doi: 10.1002 / 2.12024元人民币
14.PJ价格。哺乳动物细胞培养基选择的最佳实践。Vitr细胞开发生物学- Anim.2017; 53(8): 673 - 681。doi: 10.1007 / s11626 - 017 - 0186 - 6
15.Cote RJ。细胞培养的无菌技术。Curr Protoc细胞生物学.1998; 21(1): 1.3.1-1.3.10。cb0103s00 doi: 10.1002/0471143030.
16.戴维斯JM,谢德KL.细胞培养中的无菌技术。工业生物技术百科全书.John Wiley & Sons公司;2009:1-20。eib059 doi: 10.1002/9780470054581.
17.人颊粘膜成纤维细胞原代细胞系的分离、培养和特性:外植体酶酶学技术的结合。J口腔颌面痛.2020; 24(1): 68 - 75。doi: 10.4103 / jomfp.JOMFP_282_19
18.Freshney RI。主要的文化。动物细胞的培养.John Wiley & Sons公司;2005.cac012 doi: 10.1002/0471747599.
19.杨永林,宋建军,王志刚。支原体在细胞培养中的检测。Nat Protoc.2010; 5(5): 929 - 934。doi: 10.1038 / nprot.2010.43
20.陈楚林。荧光Hoechst 33258染色法原位检测细胞支原体污染。Exp Cell Res.1977, 104(2): 255 - 262。0014 - 4827 . doi: 10.1016 / (77) 90089 - 1
21.Cadena-Herrera D, Esparza-De Lara JE, Ramírez-Ibañez ND,等。三种活细胞计数方法的验证:手动、半自动和自动。Biotechnol报告.2015; 7:9-16。doi: 10.1016 / j.btre.2015.04.004
22.血细胞计数仪。组织培养.爱思唯尔;1973:395 - 397。doi: 10.1016 / b978 - 0 - 12 - 427150 - 0.50098 x
23.Kim TK, Eberwine JH。哺乳动物细胞转染:现在和未来。生物肛门化学.2010, 397(8): 3173 - 3178。doi: 10.1007 / s00216 - 010 - 3821 - 6
24.王志强,王志强。基因转染试剂的研究进展。Curr药物交付.2005; 1(2): 165 - 193。doi: 10.2174 / 1567201043479902
25.Kumar P, Nagarajan A, Uchil PD。脂质转染。冷泉哈布议定书.2019, 2019(3): 184 - 187。doi: 10.1101 / pdb.top096248




