更近一步CRISPR-Cas9癌症疗法

一旦CRISPR-Cas9基因组编辑技术可用,全世界的科学家开始利用它来学习更多关于遗传疾病和发展将是基因治疗的一个新类。CRISPR-Cas9更精确,易于使用的和负担得起的比以前的基因组编辑技术,如锌指核酸酶和转录activator-like效应核酸酶。这也难怪生物医学研究人员成为发展为临床应用特别感兴趣。
的确,临床试验已经开始疗法CRISPR-Cas9应用到正确的单基因突变来治疗疾病,如镰状细胞病和beta-thalassemia。到目前为止这些疗法应用基因组编辑体外执行编辑,这意味着对病人的细胞外的病人。造血干/祖细胞从病人的血液中提取,使用CRISPR-Cas9编辑,然后返回到病人,几乎以相同的方式作为干细胞移植到患者疾病如白血病。然而,将使用的治疗方法正在开发中在活的有机体内CRISPR基因编辑,在病人将被执行。另一个必然性是将重心由单基因(单基因)多基因(多基因)的障碍。
CRISPR-Cas9和癌症
但更常见疾病,如癌症吗?虽然不是一个立即的飞跃,癌症是一种多因素疾病,其中包括一个变异的基因影响。虽然没有完全确定的癌症的发展,某些基因等乳腺癌易感基因1基因,是众所周知的牵连,显著提高人的癌症风险。那么,为什么我们没有听到更多关于CRISPR-Cas9正在开发癌症治疗吗?
一个主要的障碍是肿瘤细胞基因组编辑效率低和现有运载系统的潜在毒性。的大尺寸Cas9酶(160 kD, 4300基地)和单导RNA (sgRNA;~ 31 kD, 130基地)使得他们的交货困难使用传统的病毒和病毒的方法。这是真诚的相对较低的基因编辑效率实现CRISPR-Cas9使用当前的交付方法non-liver组织和肿瘤。如果CRISPR-Cas9成功在癌症治疗,提高编辑效率需要达到一致。
重新设计单指导rna和脂质纳米颗粒治疗基因组编辑
实现这一目的的方法之一是采用另一种输送系统。其中一个选项是脂质纳米粒子(lnp)已经被用来成功地交付核酸在批准临床治疗和疫苗(如冠状病毒mRNA疫苗)。lnp lipid-based纳米颗粒,主要由阳离子得脂质胆固醇和其他辅助脂质。他们有能力提供大型有效载荷与腺相关病毒(装甲防护),最常被使用在活的有机体内CRISPR-Cas9研究(见图1)。装甲防护也无法瞄准特定细胞,容易引发免疫反应,并在高剂量肝毒素的。虽然其他运载系统CRISPR已经探索了临床应用,他们仍然受到安全问题和低编辑吗效率。
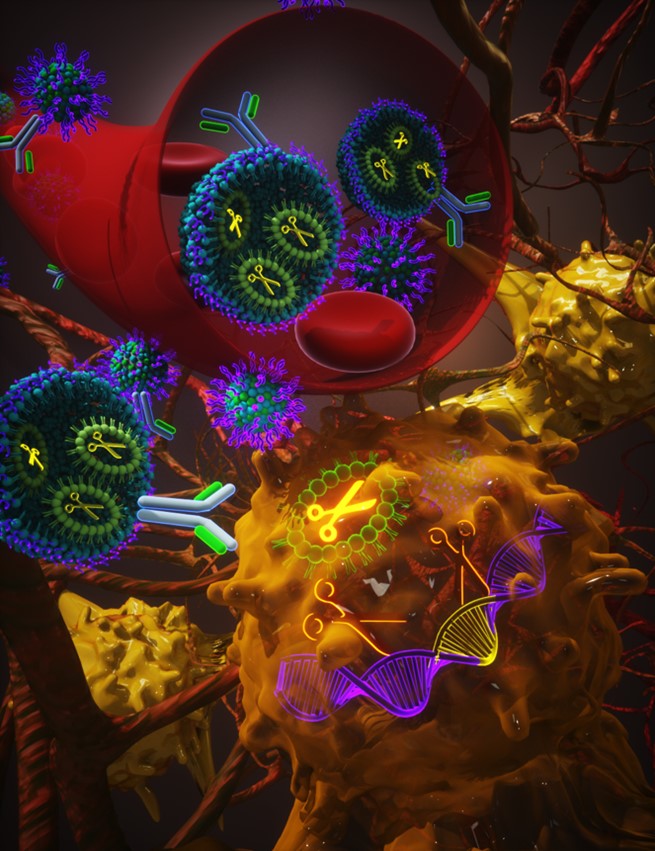
最近,针对病毒性LNP交付系统已经开发了治疗基因组编辑。这涉及到多个障碍,克服提供定制的解决方案。例如,早期的实验是不成功的,因为sgRNA并没有持续足够长的时间在细胞信使核糖核酸(mRNA)在基因编辑翻译。
特拉维夫大学的研究人员与行业合作来生成一个更稳定的sgRNA和解决这个问题。
这sgRNA提高编辑效率显著水平,达到95 - 98%在体外在所有的细胞类型测试,根据不同的动物模型,70 - 80%体内。1一旦sgRNA足够稳定交付一起Cas9 RNA,现况必须重新设计能够封装两个RNA——比以前取得了更大的有效载荷。新lnp设计使用小说类氨基酸脂质,专门设计的项目,因此,生成氨基酸脂质结构的新型图书馆。这些LNP能够封装Cas9 RNA和sgRNA和CRISPR LNP系统成功评估在两个模型研究的积极和无法治愈的癌症。1
研究表明CRISPR lnp抑制肿瘤的生长和提高生存
建立概念证明,CRISPR现况(cLNPs)目标PLK1基因在培养细胞进行了测试。1PLK1蛋白激酶有丝分裂细胞分裂所需的酶。消除PLK1导致细胞周期阻滞和细胞分裂的细胞死亡。培养细胞的治疗sgPLK1-cLNPs导致细胞周期阻滞治疗后48小时内和细胞生存能力下降了五倍。控制CRISPR现况有针对性的绿色荧光蛋白(GFP),不必要的记者蛋白质的细胞。治疗sgGFP-cLNPs并不影响细胞的生存能力,表明cLNPs低毒性的治疗水平。
确认是否在体外发现翻译在活的有机体内,两种动物模型的积极的和无法治愈的癌症了。第一个是胶质母细胞瘤的小鼠模型,最积极的开始在大脑内的癌症类型。胶质母细胞瘤是一种几乎一致致命的癌症在人类高度侵袭性,neovascularized,多形性,渗透的免疫细胞。治疗小鼠脑部肿瘤,单一剂量的sgPLK1-cLNPs鼠脑内注入肿瘤床。这促进了~ 70%的编辑PLK1基因在肿瘤细胞,导致癌细胞死亡(通过细胞凋亡),并导致30%的改善生存和50%的肿瘤生长抑制。的生存利益是最高的报道积极的单一治疗后肿瘤。
第二个模型是一个小鼠模型的卵巢癌腹腔内传播。对于人类来说,这种类型的癌症通常是高档、转移性和耐化疗。治疗传播肿瘤,很难达到,sgPLK1-cLNPs是针对肿瘤细胞使用抗体蛋白质和高表达的肿瘤细胞。在小鼠卵巢肿瘤的情况下,抗体是针对表皮生长因子受体(EGFR)。单剂量的antibody-targeted sgPLK1-cLNPs腹腔内注入老鼠。的sgPLK1-cLNPs被发现积累了肿瘤,展示对肿瘤细胞的特异性治疗。治疗促进~ 80%的编辑PLK1基因在肿瘤细胞中,强烈抑制肿瘤的生长,导致了总体存活率增加80%。
在这两种模型,安全评价表明,cLNPs没有有毒或免疫原性,编辑是局限于肿瘤细胞。的在活的有机体内cLNPs也是安全评估在一个专门的研究中,证明没有肝毒性,根据临床症状和肝酶水平,和没有免疫原性,根据测定血浆细胞因子面板。一起效果数据,这些结果表明,CRISPR-Cas9技术能够影响基因表达在活的有机体内在肿瘤。这种癌症研究和治疗开辟了新的途径,尤其是对于激进的和无法治愈的肿瘤。此外,cLNP系统不需要限制潜在的研究治疗癌症的,但也有可能申请非肿瘤组织的靶向基因编辑治疗其他常见、复杂和多因素疾病。
参考:Rosenblum D, Gutkin Kedmi R et al。CRISPR-Cas9基因组编辑为癌症治疗使用靶向脂质纳米粒子。Sci副词。2020年11月18日,6 (47):eabc9450。doi: 10.1126 / sciadv.abc9450。
传记作者:
丹同行教授,博士,是精密的实验室主任纳米特拉维夫大学(τ)。从2020年他也是特拉维夫大学研发副总裁。
马克Behlke博士,医学博士,首席科学官集成(IDT)和DNA技术是一个国际公认的专家领域的核酸技术和一个发明家引用超过50个美国专利。在近25年IDT,马克监督研究项目和新产品开发领域的热力学DNA,基因合成、化学探针,qPCR,门店,反义RNA干扰,CRISPR基因组编辑。马克在1995年加入IDT作为一个研发顾问,并于1996年被任命为研发副总裁。他在2013年被提升为全封闭。

