蛋白质组学:原理、技术和应用程序

蛋白质组是什么?
蛋白质是生物分子组成的构建块氨基酸。蛋白质对生命来说是必不可少的,与结构、代谢、运输、免疫、信号和监管职能以及其他角色。1
“蛋白质组学”这个术语是由澳大利亚博士生,马克•威尔金斯在1994年的一次研讨会在锡耶纳,意大利。2它是一条毯子的术语,它指的是所有生物体的蛋白质可以表达。每一个物种都有它自己的、独特的蛋白质组。
基因与基因组(全套在每个有机体),蛋白质组的构成是一种不断变化的状态中随着时间的推移和整个有机体。3因此,当科学家们参考蛋白质组,他们有时也指蛋白质组在一个给定的时间点(如胚胎和成熟的生物),或蛋白质组的一个特定的细胞或组织内的器官。

蛋白质组学是什么?
蛋白质组学的研究对象是proteome-investigating如何不同的蛋白质相互作用和生物中他们扮演的角色。4
虽然蛋白表达可以推断通过研究mRNA的表达,是基因和蛋白质之间的中间人,信使rna表达水平并不总是相关蛋白质表达水平。1,3此外,信使rna的研究没有考虑蛋白质转译后的修改,乳沟,复杂的形成和本地化,或者可以产生的很多变体mRNA转录;这些都是蛋白质功能的关键。
第一个实验,符合“蛋白质组学”研究的标签进行了1975年的发展二维电泳的蛋白质。5
然而,真正的高通量鉴定多种蛋白质每样只成为可能与质谱(MS)技术的发展超过20年后。6
从那时起,拥有先进的女士的敏感性和准确性,蛋白质可以可靠地检测到attomolar范围(每10 1目标蛋白质分子18分子),7和各种其他的蛋白质组学技术已经开发和优化。
蛋白质组学可以回答的关键问题是什么?
一般来说,蛋白质组学研究提供了一个全局视图的过程潜在的健康和患病的细胞过程的蛋白质水平。34要做到这一点,每个蛋白质组学的研究通常集中在一个或多个下列方面的目标生物体的蛋白质组一次慢慢地建立在现有的知识:
蛋白质识别 |
蛋白质通常表示在一个特定的细胞类型,组织或生物作为一个整体,或蛋白质差异表达吗? |
蛋白定量 |
措施(“稳态”)总蛋白质的丰度,以及调查蛋白质周转的速度(即。,如何迅速产生蛋白质之间的周期和正在退化)。 |
蛋白质的定位 |
一个蛋白质表达和/或积累一样对蛋白质功能至关重要的时间表达式,作为细胞定位控制分子间相互作用的合作伙伴和目标是可用的。 |
转录后修饰 |
转录后修饰可以影响蛋白质激活、定位、稳定性、蛋白质相互作用和信号转导等特点,从而增加一层重要的生物复杂性。 |
功能蛋白质组学 |
这个区域的蛋白质组学主要是识别特定个人的生物功能的蛋白质,蛋白质类(例如,激酶)或蛋白质交互网络。 |
结构蛋白质组学 |
结构研究提供重要的见解蛋白质功能,“druggability”的蛋白质药物发现的目标,和药物设计。 |
蛋白质相互作用 |
研究蛋白质相互作用的蛋白质相互作用,以及他们在何时何地进行交互。 |
蛋白质组学:技术
低吞吐量方法:
1。基于抗体的方法
技术,如ELISA(酶联免疫吸附试验)和免疫印迹依赖抗体针对特定蛋白质或抗原表位的可用性来确定蛋白质和量化的表达水平。
2。凝胶的方法
二维凝胶电泳(2或2 d-page),第一个蛋白质组学技术的发展,使用电流分离蛋白凝胶基于电荷(1圣维度)和质量(2nd维)。差异凝胶电泳(消化)是一种修改的2 de,使用不同的荧光染料允许同时比较两到三个蛋白样品在相同的凝胶。这些凝胶方法用于分离蛋白质进一步分析之前,例如,质谱(MS),以及相对表达分析。
3所示。Chromatography-based方法
Chromatography-based方法可用于分离和纯化蛋白质等复杂的生物混合细胞溶解产物。例如,离子交换色谱法分离蛋白质基于电荷,大小排阻色谱法分离蛋白根据其分子大小,和亲和色谱法采用可逆的特定的亲和配体和目标蛋白质之间的相互作用(例如,使用净化IgM和IgA分子凝集素)。这些方法可以用来净化和识别感兴趣的蛋白质,蛋白质以及准备进行进一步的分析,例如,下游女士。8
高通量方法:
1。分析、功能和反相微阵列
蛋白质微阵列应用少量的样本为分析“芯片”(这是有时形式的载玻片表面化学改性)。特定的抗体可以固定到芯片表面,用于捕获目标蛋白质在一个复杂的样本。这称为一个分析蛋白质微阵列,这些类型的微阵列是用来衡量蛋白质的表达水平和绑定相似样本。功能蛋白质微阵列用于描述protein-RNA交互和es营业额等功能。反相蛋白微阵列,蛋白质如健康和患病的组织或细胞治疗与治疗绑定到芯片,芯片是然后用抗体探测目标蛋白质。
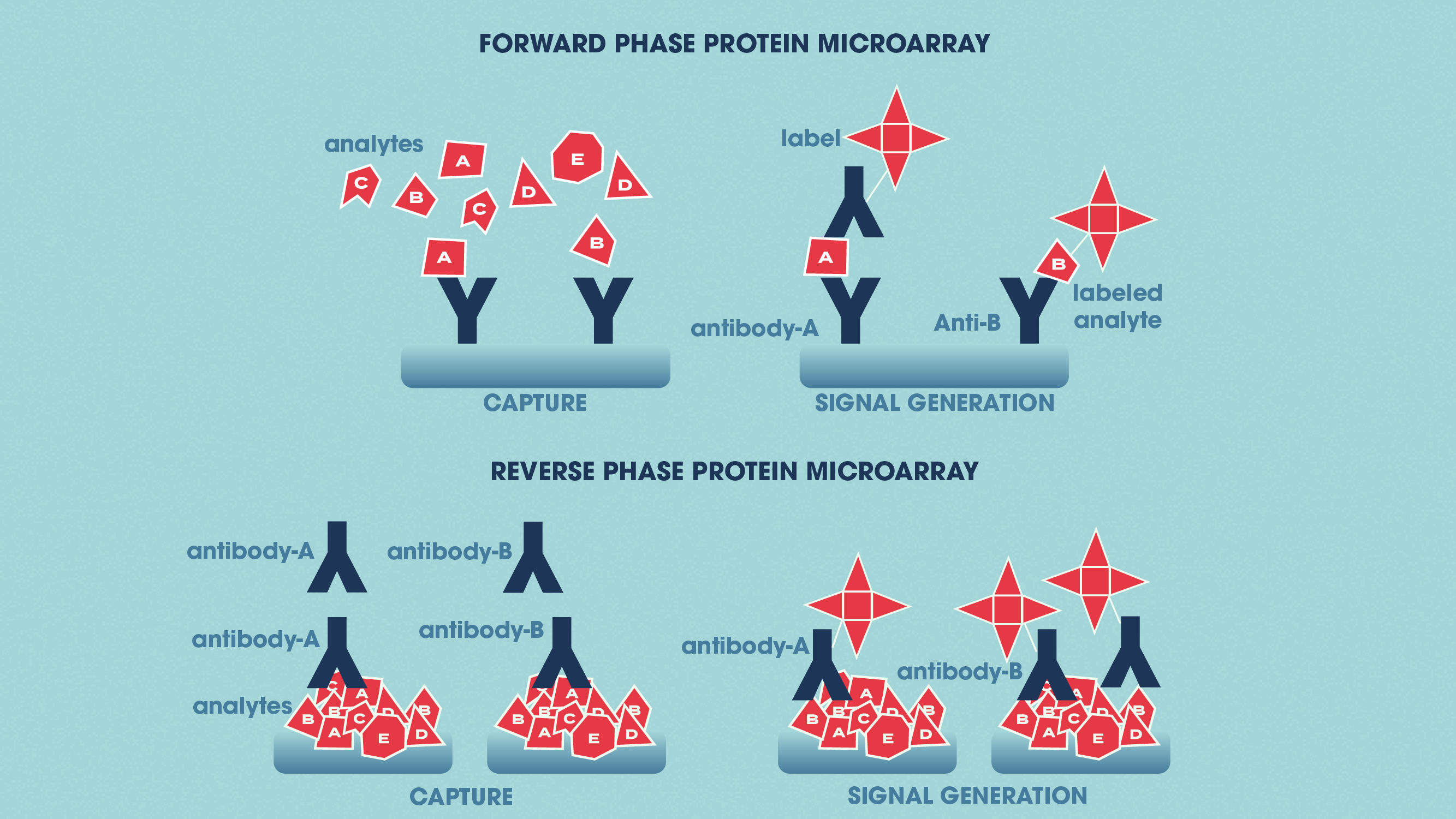 前进阶段和反向阶段之间的差异蛋白质微阵列。
前进阶段和反向阶段之间的差异蛋白质微阵列。

2。质量spectrometry-based蛋白质组学
有几个“gel-free”方法分离蛋白质,包括isotope-coded亲和标签(ICAT)稳定同位素标记的氨基酸细胞培养(SILAC)和等压标签进行相对和绝对定量(iTRAQ)。这些方法允许定量和比较/差异蛋白质组学。还有其他,较少定量技术,如多维蛋白质识别技术(MudPIT),提供更快和更简单的优点。其他gel-free,色谱技术包括蛋白质分离气相色谱法(GC)和液相色谱(LC)。8,9
质谱分析工作流程
无论如何分离蛋白质样品,下游女士工作流包含三个主要步骤:
1。蛋白质/肽电离的离子源质谱计。
2。根据它们的质量产生的离子分离电荷比的质量分析。
3所示。离子检测。
当使用gel-free技术如iTRAQ或SILAC女士的上游,直接用于样本输入到质谱仪。当使用凝胶技术,蛋白质斑点是第一的凝胶和消化之前由LC或直接分析。
有两个主要的电离源,即:
- Matrix-assisted激光解吸电离(MALDI)
- 电喷雾电离(ESI)

其它不太常见的来源包括化学电离,电子影响和辉光放电电离。
有四个主要质量分析仪:
- 飞行时间(TOF)
- 离子阱
- QuadrupoleFourier-transform离子回旋(FTIC)
- 静电部门和磁领域是另外两个,一般采用质量分析器。
串联女士是什么?
肽可以被多次分裂和质量分析过程称为串联,女士/小姐或女士n。通过结合相同或不同的质量分析器在串联,如quadrupole-TOF (Q-TOF)或triple-quadrupole(回调)女士,不同质量分析器可以利用的优势,进一步提高proteome-wide分析能力。简单的设置,如MALDI-TOF女士只用于肽质量测量,而串联质谱仪用来确定肽序列。
自上而下的蛋白质组学与自下而上的蛋白质组学
在自上而下的蛋白质组学,感兴趣的蛋白质样品中首次分离单独的特点。1,10
与自下而上proteomics-also叫做“散弹枪“proteomics-all样本的蛋白质首先被消化成肽的复杂混合物,然后进行分析,以确定哪些这些肽蛋白是存在于样品。1,10
方法 |
描述 |
方法 |
自上而下的蛋白质组学 |
蛋白质样品中感兴趣的特征首先单独分离之前。 |
蛋白质分离的执行是基于质量和电荷,例如,2 de,消化或女士使用二维电泳技术时,凝胶的蛋白质首先被解决,然后单独消化成多肽,由质谱仪分析。直接使用女士时,未消化的示例包含整个蛋白质注入质谱仪,蛋白质分离,然后选择和个体蛋白质消化和新一轮女士多肽进行分析。 |
自底向上的蛋白质组学,或者“猎枪”蛋白质组学 |
样本中所有的蛋白质首先被消化成肽的复杂混合物,然后进行分析,以确定哪些这些肽蛋白是存在于样品。 |
蛋白质首先被消化,消化肽混合物分离并受女士,女士经常在一个质/配置。由此产生的肽序列比较现有数据库使用自动搜索算法。这些搜索引擎匹配实验获得的肽谱预测产生的蛋白质谱的硅片消化(这被称为“peptide-spectrum匹配”)。有几个不同的自底向上的工作流可能,包括视和data-independent方法,以及混合动力汽车。 |
自顶向下和自底向上的方法都有其自身的优缺点和应用程序,每个更适合。10,11例如,自上而下的女士更适合研究不同的多功能天车和蛋白亚型。然而,它受限于固有困难复杂的蛋白质混合物分离和减少敏感性女士向更大的蛋白质(特别是> 50到70 kDa)。1
相比之下,而自下而上的女士使用的肽(~ 5到20个氨基酸长度)更容易分离,电离和片段,这种方法提供了一种间接测量的蛋白质最初出现在样品和严重依赖推理。1一个混合”middle-down”的方法已经被开发出来,拥有更大的肽片段比传统的自下而上的蛋白质组学,从而可能允许更多独特的肽匹配。

自顶向下和自底向上的差异蛋白质组学。
在蛋白质组学数据分析
蛋白质组学的研究,尤其是使用高通量技术,可以产生大量的数据。12除了已有的大量数据,蛋白质组学数据分析也可以相对复杂的对某些技术如猎枪。13增加这种复杂性的范围生物信息学工具可用于蛋白质组学分析。14- - - - - -17
蛋白质组学研究人员正面临着许多障碍,当试图优化仓库并分析其蛋白质组学数据。12
当规划蛋白质组学实验中,科学家需要因素不仅成本的试剂和实验室设备,数据存储和分析,他们评价所需的水平的生物信息学技术和计算资源。
蛋白质组学研究往往需要多个数据处理和分析步骤,需要执行在一个特定的序列。12为了解决这个需要,研究人员越来越多地组装所需的脚本,工具和软件定制蛋白质组学分析管道适合他们的特定的研究问题。
蛋白质组学的应用
蛋白质组学的应用非常大量的多样。下表列出了一些这些应用程序,并提供链接的例子使用这些方法的研究。
蛋白质组学的应用 |
说明和示例 |
个性化医疗 |
裁剪疾病治疗每个病人基于他们的遗传和表观遗传组成,以提高疗效和减少不良反应。虽然基因组学和转录组的主要焦点这样的研究到目前为止,蛋白质组学数据可能会添加一个进一步的维度针对病人的管理。 |
生物标志物的发现 |
识别的蛋白质标记如的诊断和预后胶质母细胞瘤,评估病人的治疗等干预措施干细胞移植。 |
药物发现和开发 |
识别潜在的药物靶点,研究druggability选择蛋白质的目标,和开发药物针对候选目标(例如,治疗性蛋白质肝细胞癌)。 |
系统生物学 |
系统调查疾病的途径host-pathogen交互识别潜在的生物标志物和治疗靶点;系统的调查药物作用、毒性、阻力和功效。 |
农业 |
的调查植物与交互作物工程增加弹性,例如,洪水、干旱等环境压力。 |
食品科学 |
食品安全和质量控制,过敏原检测和提高食品的营养价值。 |
Paleoproteomics |
古老的蛋白质的研究,进一步的理解进化和考古学。 |
天体生物学 |
调查的哺乳动物的免疫系统可能如何应对exo-microbes空间和研究发现的生命起源以前的有机物质在陨石中找到。 |
蛋白质组学的未来
目前,蛋白质组学工作流严重依赖女士。1这么强大的技术已经被证明,研究人员现在展望未来的蛋白质组学是“超越”女士尽管attomolar女士的敏感性,数以百万计的目标分子仍然需要在样品被检测到。这意味着低浓度目标分子(如血清生物标志物)可以在复杂的环境,比如人类血清检测不到,除非第一丰富。
科学家们仍在寻找圣杯的高通量蛋白质组学技术,1)具有良好的灵敏度的动态范围目标蛋白质组(例如,107人类蛋白质组),2)可以直接读取整个蛋白质序列和识别他们的天车,和,因此,3)不需要从数据库理论作出推论蛋白质匹配。1
有几个有前途的技术,而目前在灵敏度受到限制,吞吐量或成本,最后可能还是会在蛋白质组学领域占据主导地位。1这些包括新生荧光指纹方法和有待开发subnanopore蛋白质的高通量单分子测序的数组。
与预期的蛋白质组学技术的发展,蛋白质组学数据分析方法有望发展迅速。例如,有很强的动力对发展云计算等技术数据,软件容器和工作流系统,进入“大众化”一流的蛋白质组学数据分析计算资源,无论研究人员的位置、IT基础设施或计算技术。12,18,19
引用:
1)Timp W, Timp g .质谱之外,蛋白质组学的下一步。Sci睡觉。2020;6 (2):eaax8978。doi:10.1126 / sciadv.aax8978。
2)威尔金斯m .蛋白质组学数据挖掘。专家加速蛋白质组学。2009;6 (6):599 - 603。doi:10.1586 / epr.09.81。
3)Beynon RJ。蛋白质组的动态:proteome-wide范围内测量蛋白质周转的策略。短暂的功能基因组蛋白质组学。2005;3 (4):382 - 390。doi:10.1093 / bfgp / 3.4.382。
4)盖伦霁。蛋白质组。米勒:布伦纳,JH, eds。百科全书的遗传学。伦敦:学术出版社;2001:1575 - 1578。
5)坟墓的公关,Haystead助教。蛋白质组学的分子生物学家的指南。Microbiol杂志牧师。2002年,66 (1):39 - 63。doi:10.1128 / mmbr.66.1.39 - 63.2002。
6)安徒生JS,曼通过质谱分析功能基因组学。2月列托人。2000年,480 (1):25-31。doi:10.1016 / s0014 - 5793 (00) 01773 - 7。
7)Bekker-Jensen DB, Martinez-Val Steigerwald年代,等。一种紧凑quadrupole-orbitrap质谱仪与“界面改善蛋白质组覆盖总之LC梯度。摩尔细胞蛋白质组学。2020;19 (4):716 - 729。doi:10.1074 / mcp.TIR119.001906。
8)Aslam B Basit M,这个妈,得以M, Rasool MH。蛋白质组学:技术和他们的应用程序。J Chromatogr Sci。55 2017;(2):182 - 196。doi:10.1093 / chromsci / bmw167。
9)华K,钱PY。蛋白质组学:挑战,技术和可能性来克服生物样品的复杂性。哼基因组蛋白质组学。2009;2009:239204。doi:10.4061 / 2009/239204。
10)张Y, Fonslow BR,山B门敏MC,耶茨JR第三。蛋白质猎枪/自下而上的蛋白质组学的分析。化学牧师。2013,113 (4):2343 - 2394。doi:10.1021 / cr3003533。
11)张H,通用电气y综合分析蛋白质修饰的自上而下的质谱。中国保监会Cardiovasc麝猫。2011;4 (6):711。doi:10.1161 / CIRCGENETICS.110.957829。
12)佩雷斯必经Riverol Y,莫雷诺p .可伸缩的数据分析在蛋白质组学和代谢组学利用BioContainers和工作流引擎。蛋白质组学。2020;20:1900147。doi:10.1002 / pmic.201900147。
13)胡锦涛,高贵的WS, Wolf-Yadlin A .蛋白质组学的技术进步:新发展data-independent收购。F1000Res。2016;5:F1000教员牧师- 419。doi:10.12688 / f1000research.7042.1。
14)关J, Rapacki K,职责分明H, et al。工具和数据服务注册中心:一个社区努力文档生物信息学资源。核酸Res。2016;44 (D1): D38-D47。doi:10.1093 / nar / gkv1116
15)亨利·VJ Bandrowski AE, Pepin,冈萨雷斯BJ, Desfeux OMICtools: multi-omic数据分析的信息目录。数据库。2014;2014:bau069。doi:10.1093 /数据库/ bau069。
16)Afgan E,贝克D, Batut B, et al .银河系的访问平台,可再生的和合作的生物医学分析:2018更新。核酸Res。2018;46 (W1): W537-W544。doi: 10.1093 / nar / gky379。
17)Tsiamis V, Ienasescu H, Gabrielaitis D, Palmblad M, Schwammle V,关j .一千零一软件蛋白质组学:科学的工具的故事。J蛋白质组Res。2019;18 (10):3580 - 3585。doi:10.1021 / acs.jproteome.9b00219。
18)科尔BS,摩尔JH。十一个小贴士与云计算架构生物医学信息学工作流。公共科学图书馆第一版杂志。2018;14 (3):e1005994。doi:10.1371 / journal.pcbi.1005994。
19)Lawlor B,看到路的民主化生物信息学:软件工程的观点。GigaScience。2020;9 (6):giaa063。doi:10.1093 / gigascience / giaa063。




