τ细丝从阿尔茨海默氏症的大脑结构解决了低温电子显微镜

医学研究委员会的研究人员的分子生物学实验室,剑桥,英国已经解决了的结构dementia-causingτ蛋白以前所未有的细节。使用脑组织从死去的74岁的阿尔茨海默氏症病人,研究人员孤立tau蛋白质和探索其结构使用低温电子显微镜(低温电子显微镜)。他们了解τ蛋白组装成细丝可以更好,更明确的诊断类型的痴呆了,使疾病的靶向治疗。
了解更多:低温电子显微镜解释Sjors谢尔
τ蛋白:微小但破坏性的
六种τ蛋白存在,范围从352到441个氨基酸长度。当功能通常在大脑神经细胞,这些蛋白质绑定到微管稳定他们的形成和维护和被认为是保护大脑。然而,如果τ蛋白细丝神经元内总他们可以累积成大缠结,破坏细胞的形状和影响其正常工作的能力,最终杀死它。这种类型的细胞损失导致破坏性的变性痴呆病人的大脑和基础疾病的症状。
是什么导致τ蛋白组装错误仍然是未知的。证据收集一些异常τ分子与特定的重复图案可以影响或种子疾病这一中断正常tau蛋白质和蔓延,给他们传染性属性。
资深作者,米歇尔Goedert解释说,“我们已经知道在几乎三十年的时间τ蛋白的异常组装成纤维是一种阿尔茨海默病的特点。1998年,τ蛋白的功能障碍被证明是足够的神经退化和痴呆。2009年,prion-like组装τ被确定的属性。这些属性允许异常形式转换之前正常形式。”
丰富τ蛋白tauopathies喜欢的标志阿尔茨海默病,慢性创伤性脑病,皮克病和其他人。尽管阿尔茨海默氏症略有不同的病理患者也有特点的β淀粉样蛋白斑块周围组织他们的脑细胞。
了解异常τ蛋白组装成细丝,积累到纤维是非常重要的,是破坏的形成危险的聚合的发展可以促进治疗tauopathies和痴呆。
读类似:τ蛋白与阿尔茨海默氏症下降
直接从大脑低温电子显微镜:提供见解
直到现在,努力解决tau蛋白的结构需要更大数量的蛋白质比产生在大脑病变。这意味着蛋白质都是在实验室中使用细胞和纤维人工骨料在培养皿中。虽然强大的见解,τ丝是否总这样的问题在人类的大脑依然存在。
的一个关键的好处利用低温电子显微镜在这项研究是较少的蛋白质是必需的,这意味着τ可以直接从人类大脑病变被孤立。作为第一作者,Sjors Schere的解释道:“解决这些蛋白质的结构在原子级别从实际的脑组织,第一次,是本研究的最大成就之一。”

解决革命:改进的解决能力
由改进的电子检测和更好的软件建模蛋白质结构,低温电子显微镜分辨率革命使大,结构复杂,以前无法解决的蛋白质结构在原子层面上得到解决。谢尔集团解决了τ蛋白结构在3.4 - 3.5埃分辨率,在埃是1一米的10000000000大小。科学家们能够模型tau蛋白的组装到丝通过使用一个附加的“RELION”结构建模软件包,最初由Sjors开发的组织,研究作者Shaode他写的。
丝状的发现
当组孤立和成像τ细丝从阿尔茨海默氏症的大脑,他们发现τ蛋白被安排在两种类型的灯丝,paired-helical细丝和直丝。团队绘制了结构的原子排列异常τ蛋白,注意的是他们有相似的结构图案的淀粉样蛋白和朊病毒蛋白质。朊病毒,传染性和引起痒病、牛海绵状脑病(BSE)的牛、羊人类克雅氏病(CJD)。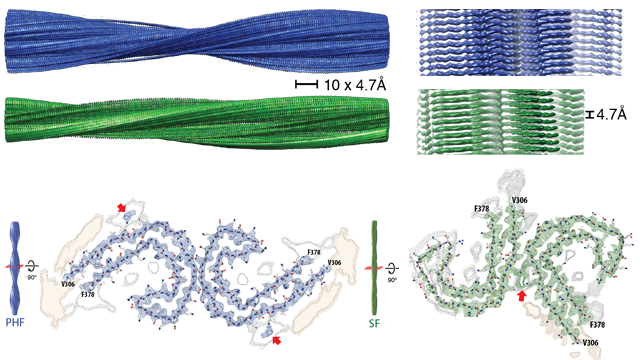
作者表明,在paired-helical细丝位于τ子单元的安排比在对称直丝。然而,连续paired-helical和细丝,τ蛋白的氨基酸组成的丝状结构的核心是相同的。至关重要的是,他们发现了氨基酸残基306 - 378作为重要的“核心”地区的蛋白质。
药物发现的故事
Sjors解释这些发现的重要性在老年痴呆症研究工作的科学家,“重要的科学家在τ领域工作,我们现在知道这对形成结构化的氨基酸是重要核心。这意味着我们现在知道的氨基酸形成的关键这种子聚合最长的形式的τ,患病的大脑。”Sjors也强调了一个问题的制药公司提高他们的发现重现τ聚合在一道菜来设计药物破坏它。他说,“在体外聚合研究使用τ结构,从氨基酸残基244年和在372年结束。意义的构造中途停止8日β链τ蛋白。“这将意味着他们丢失大量的核心区域集团认定为丝形成的关键。
补充道,“基于我们的研究结果,制药公司应该增加结构的长度如果他们想概括丝的形成,真正测试药物来抑制paired-helical和直丝的形成。”
诊断和治疗老年痴呆症
仅在英国,517426人痴呆的诊断,但据估计,数量要高得多,患有这种疾病的850000年。在全球范围内,诊断为老年痴呆症的人数每年以惊人的速度增长。目前有超过4680万人患有老年痴呆症,这是估计上升到1.315亿人到2050年。
目前,老年痴呆症是唯一条件在全球十大死因没有治疗预防、治疗或减缓其发展。
本研究获得的洞察力可以改善痴呆的诊断。配体的设计结合τ和PET扫描仪下地图可以看到疾病进展可以专门绑定到不同亚型的背后τtauopathies不同。意义不同的痴呆可以被识别和监控的实时成像的大脑扫描。
看到的: 通过PET扫描测量疾病进展
罗莎桑丘博士的研究主管英国阿尔茨海默氏症研究的重要性进行了解释解决τ的结构而言,寻找治疗痴呆,“τ蛋白的积累是一个不同的大脑退行性疾病的特点,以及这些工作可以帮助回答关键问题为何它开始的行为异常,以及它如何会导致这样一个各种各样的条件。以及提高我们对阿尔茨海默氏症等疾病的理解,了解τ的精确结构将帮助研究新的治疗方法。药物能够清除团大脑蛋白质的研究人员的一个关键目标,但直接影响这些蛋白质分子组成药物需要抓住并绑定到其表面。了解这些复杂的蛋白质结构的精确形状非常有价值的指导靶向药物的发展。”
解决病态的结构形式的τ的洞察力从人类大脑和如何将这些蛋白质组装成细丝τ领域是一个巨大的利好,将希望打开门更好的治疗和治愈阿尔茨海默氏症。
和他的实验室Sjors确定接下来的步骤,“我们现在想看看τ从大脑诊断为其他tauopathies以便我们能解决所有的人类tauopathies的灯丝结构。”
您可以遵循@SjorsScheres在推特上和追随他的实验室的工作在这里。


