基于片段的药物发现研究进展

阅读时间:
在过去的十年里,基于碎片的药物发现(FBDD)在药物发现专家中引起了越来越多的兴趣,并已成为该领域的关键方法——作为发现高质量先导候选药物的替代起点。尽管几种筛选技术的进步无疑推动了FBDD的发展,但将基于片段的方法应用于更复杂的生物靶标仍然是一个挑战。1
本文讨论了FBDD的发展,强调了基于片段的方法所产生的关键药物发现,并探讨了利用这种方法的一些优势和挑战。
什么是基于碎片的药物发现?为什么它有用?
基于片段的药物发现始于一小部分非常小的化合物,通常由>20个非氢原子或“重”原子组成。2这些化合物的大小意味着可能碎片的数量远远低于通常由其生成的类药物分子的数量其他药物发现方法,例如高通量筛选(高温超导)。
从另一个角度来看——据估计,宇宙中可能存在的类似药物的小分子比恒星的数量还要多!3.相比之下,片段库仅由几千个微小分子组成。
规模很重要…
分子越大,就越复杂。分子的复杂性越大,与蛋白质目标相互作用的可能性就越大4-互动可能并不总是有利的。
小片段与蛋白质目标的相互作用更少,因此你可以期望它们能够更容易地结合到更多目标的更多位点上,转化为更多的“命中”。(图1)
与其他方法生成的片段库相比,片段库的大小意味着最初的片段技术主要由小型生物技术公司采用。罗德里克·哈伯德教授英国约克大学结构生物学实验室的研究员解释说:“化学文库尺寸的减小使得基于片段的方法对他们来说更容易实现。”
“大多数药物化学家花了一段时间才意识到,与使用更大、更有效的化合物相比,从一个小的、弱的亲和力打击开始更可取。”
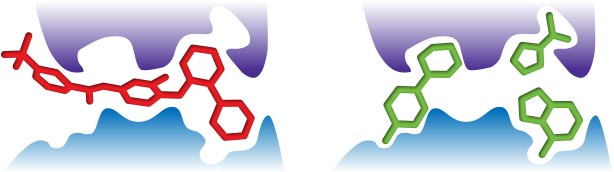
图1:HTS与蛋白靶结合片段的比较。
早在FBDD实际投入实践之前,Jencks就发表了FBDD的理论基础。6哈伯德说:“在20世纪80年代中期,计算生物学和(随后的90年代初)结构生物学社区建立了使用与蛋白质活性位点结合的化学小片段的想法。”
这一理论背景在1984年得到了进一步的补充et al。提出了单个官能团贡献的内在结合能,可用于确定药物与其靶标的“拟合优度”。7
“基于片段的方法是第一个实用的方法应用于药物研发领域由Fesik和Hajduk团队于1996年在雅培进行的研究,”8哈伯德的评论。雅培公司的科学家使用了一种核磁共振(NMR)该方法可以识别能够与目标蛋白的近端子位点结合的片段,然后对这些片段进行优化并连接以创建高亲和力配体。9几年后,尼enaberet al。发表了一篇关于使用x射线晶体学筛选临床化合物的论文,随后,这两种方法-核磁共振和x射线晶体学-成为许多公司的焦点,他们承担了专门针对药物发现领域定制这些策略的任务。
Hubbard说:“用于识别碎片命中的各种生物物理技术的灵敏度和稳健性都取得了重要和持续的发展,重要的是,使用这些技术的经验也得到了提高。”
其他几个方法现在除了核磁共振和x射线晶体学外,还适用于FBDD。5
对于传统筛选(HTS)已经失败的新靶点,基于片段的方法尤其有价值。它能够识别可以与靶标结合的各种化学物质,为药物化学家在对化合物进行分类时提供了选择,使他们能够研究最有前途的片段,这些片段具有开发候选药物的长期潜力。
一旦您成功地识别了最初的命中,一个关键的挑战就出现了。然后,你就面临着将这些片段(它们对蛋白质靶标具有弱亲和力(通常KD值在高μM到mM范围内)转化为更有效和更有前途的配体的任务。
“片段起始点通常具有‘良好的’系统剖面——它们与蛋白质热点结合,并且有可能使用结构信息和配体效率指标对它们进行合理优化,”keser“指出。
有效的片段优化通常包括两个关键步骤。首先,需要与目标蛋白结合的片段的共结构,以便选择最佳的命中片段,然后考虑将其开发为领先候选片段。7第二步包括进行一些生物物理和生化分析,以跟踪片段的效力和功效。6这些额外的分析补充了先前从最初的生物物理研究中获得的数据,增强了药物化学家的预测能力——用于合理的设计。
用于片段细化的主要方法有三种。第一种是“连接”,即在不同蛋白质靶位点结合的非重叠片段连接在一起,产生新的化学序列。另一种是“合并”,这涉及到将重叠片段的共同结构部分与目标蛋白结合。1第三是碎片“生长”,即围绕单个碎片形成“合理的化学反应”。10
哈伯德解释说:“2000年代中后期的成功导致大多数公司采用基于片段的方法,现在有许多已发表的成功故事,从弱的mM片段攻击到强效的nM候选药物,用于“常规”药物靶点,如激酶和大多数酶。
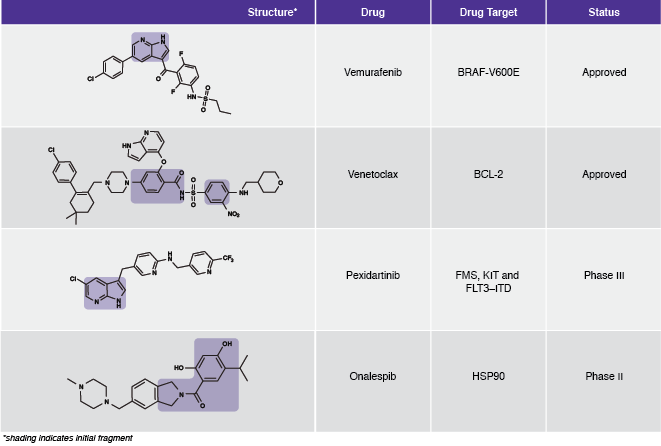
表1:fbdd衍生药物的例子。
在早期,FBDD被认为是HTS的替代方法。然而,最近越来越多的人认为,这两种方法实际上是互补的,而不是竞争的,采用这两种策略你可能会有明显的优势。
“虽然碎片筛选经常被用作‘备份’,但对于没有HTS命中的目标,现在碎片筛选和HTS是并行应用的。FBDD方法可能有助于描述靶点的药物性,并识别由HTS确认的结构部分。这将有助于HTS命中的优先级和更有效的优化,”keserharp指出。
“Fragments和HTS是一个强大的组合。片段命中可用于挖掘公司化合物收集的近邻,可以在比HTS更敏感的分析中进行评估。Hubbard解释说:“碎片撞击为HTS撞击中的支架替换提供了许多想法,碎片如何有效地与DNA编码库等其他方法结合还有待观察。”
筛选片段库可以揭示结构洞察力,使您能够识别多个弱亲和力片段命中与蛋白质目标的相互作用,指导药物化学优化。5
György Miklós kesercarp教授匈牙利皇家科学院(RCNS-HAS)药物化学研究小组的科学顾问,他提出:“……有许多重要的贡献导致了基于片段的药物发现(FBDD)方法的发展成为学术界和制药公司的有效策略。在FBDD创始人和实践者的共同努力下,解决了许多问题,包括:文库设计、筛选和片段优化。”
建立基于片段的方法
György Miklós kesercarp教授匈牙利皇家科学院(RCNS-HAS)药物化学研究小组的科学顾问,他提出:“……有许多重要的贡献导致了基于片段的药物发现(FBDD)方法的发展成为学术界和制药公司的有效策略。在FBDD创始人和实践者的共同努力下,解决了许多问题,包括:文库设计、筛选和片段优化。”
基于碎片的药物发现的理论基础
早在FBDD实际投入实践之前,Jencks就发表了FBDD的理论基础。6哈伯德说:“在20世纪80年代中期,计算生物学和(随后的90年代初)结构生物学社区建立了使用与蛋白质活性位点结合的化学小片段的想法。”
这一理论背景在1984年得到了进一步的补充et al。提出了单个官能团贡献的内在结合能,可用于确定药物与其靶标的“拟合优度”。7
碎片结合检测:先进的生物物理技术
“基于片段的方法是第一个实用的方法应用于药物研发领域由Fesik和Hajduk团队于1996年在雅培进行的研究,”8哈伯德的评论。雅培公司的科学家使用了一种核磁共振(NMR)该方法可以识别能够与目标蛋白的近端子位点结合的片段,然后对这些片段进行优化并连接以创建高亲和力配体。9几年后,尼enaberet al。发表了一篇关于使用x射线晶体学筛选临床化合物的论文,随后,这两种方法-核磁共振和x射线晶体学-成为许多公司的焦点,他们承担了专门针对药物发现领域定制这些策略的任务。
Hubbard说:“用于识别碎片命中的各种生物物理技术的灵敏度和稳健性都取得了重要和持续的发展,重要的是,使用这些技术的经验也得到了提高。”
其他几个方法现在除了核磁共振和x射线晶体学外,还适用于FBDD。5
例子包括:
- 底物活性筛选.在这种筛选策略中,可以快速识别和优化特定蛋白质目标的底物。它允许将片段转化为半胱氨酸和丝氨酸蛋白酶的非肽抑制剂。
- SPR光谱.这项技术包括将目标蛋白质固定在金属涂层芯片上,并允许片段流过。在结合时发生片段-蛋白质质量的变化,导致金属芯片的反射特性发生变化,从而实现实时检测。
- 虚拟筛选.计算方法可以阐明片段和蛋白质目标之间的分子相互作用。该方法可用于预测结构信息,并检查片段与多个蛋白质目标的结合。
哈伯德解释说:“FBDD允许你从小处开始,因此药物化学家可以构建有效的先导化合物,但是,在传统的功能检测中,最初的片段碰撞可能需要一些时间(和精力)。”
片段优化
对于传统筛选(HTS)已经失败的新靶点,基于片段的方法尤其有价值。它能够识别可以与靶标结合的各种化学物质,为药物化学家在对化合物进行分类时提供了选择,使他们能够研究最有前途的片段,这些片段具有开发候选药物的长期潜力。
一旦您成功地识别了最初的命中,一个关键的挑战就出现了。然后,你就面临着将这些片段(它们对蛋白质靶标具有弱亲和力(通常KD值在高μM到mM范围内)转化为更有效和更有前途的配体的任务。
“片段起始点通常具有‘良好的’系统剖面——它们与蛋白质热点结合,并且有可能使用结构信息和配体效率指标对它们进行合理优化,”keser“指出。
有效的片段优化通常包括两个关键步骤。首先,需要与目标蛋白结合的片段的共结构,以便选择最佳的命中片段,然后考虑将其开发为领先候选片段。7第二步包括进行一些生物物理和生化分析,以跟踪片段的效力和功效。6这些额外的分析补充了先前从最初的生物物理研究中获得的数据,增强了药物化学家的预测能力——用于合理的设计。
片段合并、连接和成长
用于片段细化的主要方法有三种。第一种是“连接”,即在不同蛋白质靶位点结合的非重叠片段连接在一起,产生新的化学序列。另一种是“合并”,这涉及到将重叠片段的共同结构部分与目标蛋白结合。1第三是碎片“生长”,即围绕单个碎片形成“合理的化学反应”。10
从基于片段的方法衍生的药物
哈伯德解释说:“2000年代中后期的成功导致大多数公司采用基于片段的方法,现在有许多已发表的成功故事,从弱的mM片段攻击到强效的nM候选药物,用于“常规”药物靶点,如激酶和大多数酶。
表1:fbdd衍生药物的例子。

数量优势:将基于片段的方法与其他方法相结合
在早期,FBDD被认为是HTS的替代方法。然而,最近越来越多的人认为,这两种方法实际上是互补的,而不是竞争的,采用这两种策略你可能会有明显的优势。
“虽然碎片筛选经常被用作‘备份’,但对于没有HTS命中的目标,现在碎片筛选和HTS是并行应用的。FBDD方法可能有助于描述靶点的药物性,并识别由HTS确认的结构部分。这将有助于HTS命中的优先级和更有效的优化,”keserharp指出。
“Fragments和HTS是一个强大的组合。片段命中可用于挖掘公司化合物收集的近邻,可以在比HTS更敏感的分析中进行评估。Hubbard解释说:“碎片撞击为HTS撞击中的支架替换提供了许多想法,碎片如何有效地与DNA编码库等其他方法结合还有待观察。”
基于碎片的药物发现:未来会怎样?
有几种技术有发展和改进的潜力,以最大限度地提高基于碎片的药物发现的成功。“我希望看到更敏感、更可靠、无标签的检测技术,不仅可以用于识别命中化合物,还可以用于支持片段-命中-先导阶段的优化。哈伯德说。
筛选技术的进步将是推动FBDD向前发展的关键,并使其适应更具挑战性的目标。keser科普德指出:“碎片技术已经实现了显著的多样化。SPR和配体检测核磁共振仍然被频繁使用,然而,x射线晶体学和蛋白质检测核磁共振屏幕越来越受欢迎,因为它们从一开始就提供了片段结合的直接结构信息。”
keserjosh继续说:“我相信,在高分辨率x射线晶体学和生物物理技术的支持下,计算技术的不断发展可能有助于使设计过程更有效。”
尽管自20世纪80年代以来,FBDD已经取得了长足的进步,但在学习处理更具挑战性的新目标的最佳方法方面,仍有一段路要走。哈伯德认为,一个重要的考虑因素是“投入时间来生成正确的试剂——既包括生物物理和结构研究所需的蛋白质结构,也包括开发可靠的初级分析来报告配体结合——包括定义翻译后修饰的目标或结合修饰功能的伙伴。”
哈伯德总结说:“当其他方法失败时,仍然有一种倾向,即将碎片作为解决方案,我们仍在学习如何在更具挑战性的新目标类别上使用这些技术。”
参考文献
1.Velvadapu, V., Farmer, BT., Reitz, AB.(2015)第7章:基于片段的药物发现。药物化学实践“,”从检索https://www.sciencedirect.com/science/article/pii/B9780124172050000079
2.Erlanson DA, Fesik SW, Hubbard RE, Jahnke W, Jhoti H. 20年:碎片对药物发现的影响。Nat. Rev.药物发现, 2016; 15(9), 605 - 619。doi:
10.1038 / nrd.2016.109
3.李国强,李国强。基于结构的药物设计的艺术和实践:分子建模的视角。神父医师1996; 16(1), 3-50。doi:10.1002 / (sici) 1098 - 1128 (199601) 16:13.3.co;二维
4.Hann MM, Leach AR, Harper G.分子复杂性及其对药物发现先导物概率的影响。化学通知计算科学.41 2001;(3), 856 - 864。doi:10.1021 / ci000403i
5.惠特克M,等。片段:过去、现在和未来。药物。今天抛光工艺。7 (3), e163-eE171。2010;doi:
10.1016 / j.ddtec.2010.11.007
6.Jencks WP。结合能的归因和可加性。PNAS.1981, 78(7), 4046 - 4050。doi:10.1073 / pnas.78.7.4046
7.Andrews PR, Craik DJ, Martin JL。官能团有助于药物受体相互作用。医学。化学。1984年,27(12)1648 - 1657。doi:10.1021 / jm00378a021
8.Shuker SB, Hajduk PJ, Meadows RP, Fesik SW。发现蛋白质的高亲和配体:NMR的SAR。科学。1996, 274(5292), 1531 - 1534。doi:10.1126 / science.274.5292.1531
9.基于结构的药物发现中的片段方法。J同步辐射。2008; 15:227 - 230。doi:10.1107 / S090904950705666X
10.斯科芬R,斯莱特M.碎片思想的虚拟阐述:生长,合并和链接碎片与现实化学。药物发现;dev. deliv.7(2), 36-40。
广告



