药物输送

一种药物的疗效会受到其给药方式的显著影响。通过开发各种药物输送系统(DDSs),现在有可能更好地控制药物动力学药物的药效学、毒性、免疫原性和疗效。
通过找到最适合特定药物分子的传递机制,就有可能“优化”药物在体内的性能。下面我们就来看看其中的不同管理方法,探讨什么是“药物输送系统”,并着重介绍主要的药物输送“载体”。1
药物可以通过几种不同的途径进入人体(图1).这些路线通常是根据它们的“起点”——给药的位置来分类的。每条路线都有自己的优点和缺点。
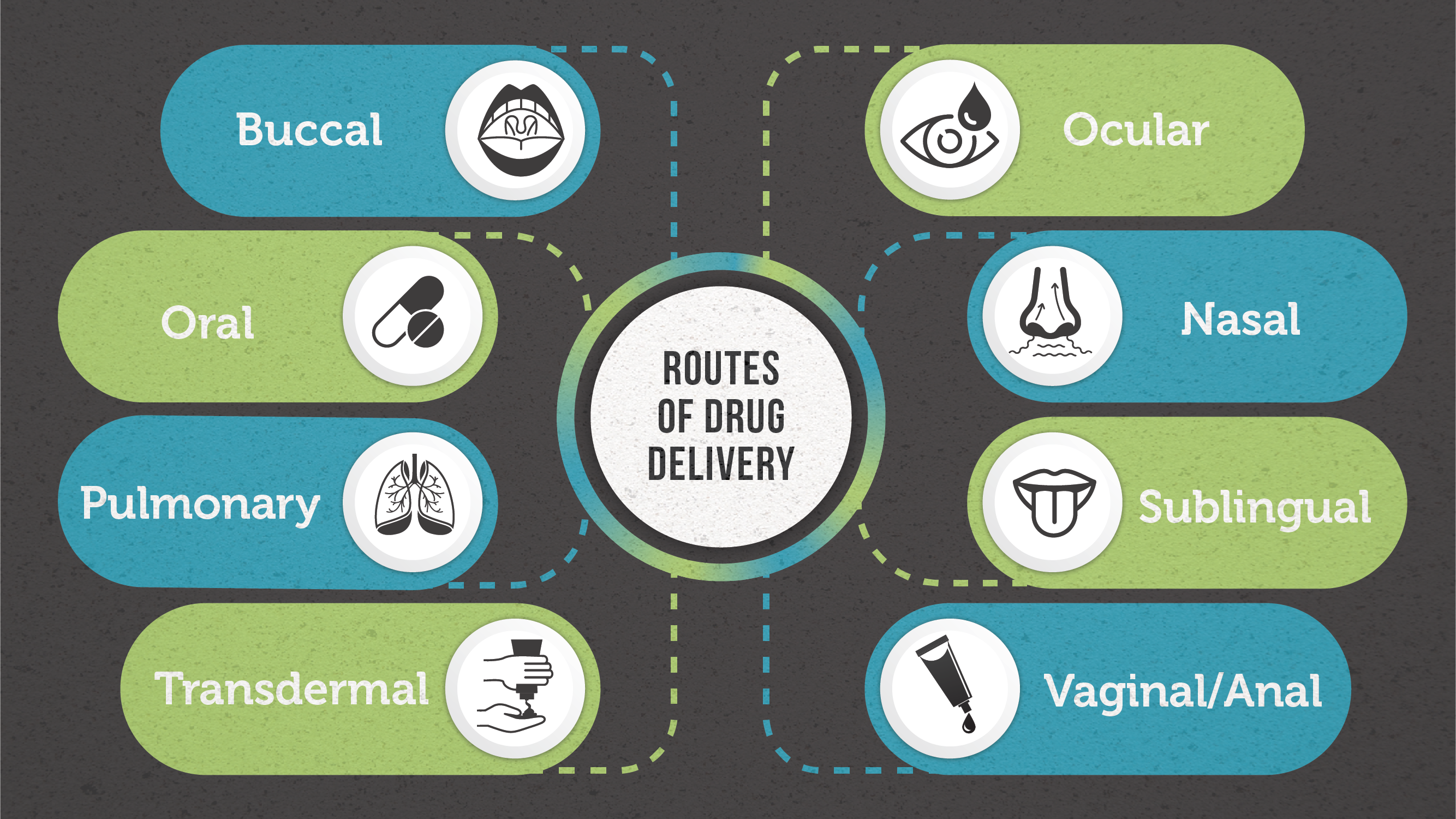
口腔给药
颊部给药是指通过颊粘膜给药。2而这种运送方式避免了初步的效果(肝脏对药物的快速吸收和代谢为非活性化合物),它是药物吸收的“具有挑战性”的障碍,特别是对于大型生物制药公司-目前仅限于具有亲脂性的小分子药物,因为它们可以很容易地穿过膜。3.由于口腔途径通常用于缓释药物输送(即药物在较长时间内以受控的方式释放),通常首选可附着在粘膜上的配方。多种配方已开发用于口腔分娩,包括;片剂、凝胶、含片和贴片。3.
鼻给药
鼻给药是指通过鼻腔给药。鼻喷雾剂通常用于治疗当地的影响上呼吸道的疾病(如鼻塞、过敏性鼻炎)。4然而,在某些情况下(例如需要快速起效),可以利用这种递送方法系统性 交付小分子药物-例如,偏头痛药物olmatriptan (Zomig®).5薄鼻粘膜血管化程度高,意味着向全身血液循环的转移迅速,与颊部给药类似,可以避免首过代谢。液体和(较少的)粉末配方可用于鼻腔给药。6
眼部给药
由于眼睛独特的解剖和生理结构——静态的、动态的和代谢性的眼屏障都阻碍了药物通过眼睛的吸收,眼内给药对于给药科学家来说一直是一项艰巨的任务。将药物输送到眼睛的特定部位有几种不同的给药途径。研究人员已经能够在一定程度上克服将药物输送到眼组织的挑战,方法是识别眼睛中特定的流出和流入转运蛋白,并修改药物以靶向这些转运蛋白。7
口服给药
口服给药由于其非侵入性、易于使用、成本效益和胃肠道(GI)的高吸收特性,是迄今为止最知名的药物给药途径,通常也是首选的给药途径。8为了使口服给药成功,应评估药物化合物在胃肠道系统中的水溶解度,以确定是否需要修改以提高生物利用度。然而,口服给药在适用于某些患者群体时确实存在缺陷,包括;儿科,老年和认知障碍患者。8
肺部给药
肺给药是指通过肺给药用嘴吸入进入呼吸道。吸入药物是治疗局部肺部疾病的有效手段。最近,肺给药也被研究为全身性疾病的一种潜在给药途径,因为肺泡区有巨大的吸收表面积和高渗透膜。肺部分娩不受饮食并发症和患者间代谢变化的影响,这是另外两个优点。9
舌下给药
舌下给药是指药物在舌下给药,然后通过舌腹表面和口腔底部被吸收到血液中。10舌下吸收迅速,因此可以迅速开始行动。这种给药途径也避免了肝脏的首过代谢。然而,它确实会干扰谈话、饮食,这是不利的。此外,吸烟会导致血管收缩,从而降低药物的吸收和疗效,因此不建议在吸烟者中使用。10
透皮给药
透皮给药是一种通过将配方应用到完整皮肤上系统地给药的方法。11最初,药物穿透角质层,然后通过深层表皮和真皮层,最终通过真皮微循环被全身吸收。12事实上,它是非侵入性的,适合无意识或呕吐的病人是两个关键的优势。
阴道/肛门给药
阴道/肛门给药途径比口服给药途径起效更快,生物利用度更高。直肠药物可以用于显示局部作用(如泻药)或全身作用(如其他途径禁忌时的镇痛药).阴道给药避免了首过代谢,不受胃肠紊乱的影响。13阴道途径通常被认为是荷尔蒙的管理和解决妇女的健康问题。众多阴道配方可供选择,包括;水凝胶、片剂、子宫托或栓剂。14
靶向给药
靶向给药方法是非常有趣的,因为它们能够集中传递药物化合物到其所需的目标-提高疗效和减少脱靶效应。

送药车
表现出低生物利用度的药物分子一旦进入体内就需要防止降解(酶和酸催化)15~ 40%的新型活性药物成分(api)由于生物利用度低而被制药工业拒收。为了解决这个问题,已经开发了载体系统来提高生物利用度并保护药物分子不被降解。在这里,我们看看三种类型的基于运营商的交付。
纳米粒子
纳米颗粒一般在100-500纳米之间。16通过修改它们的性质,有可能优化生物利用度,降低清除率,增加稳定性,使它们成为将特定药物输送到特定目标组织的理想“载体”。纳米颗粒具有良好的溶解性,由于其体积小,表面积大,因此生物利用度增加。它们作为药物携带者的吸引力在于:16
- 穿过血脑屏障(BBB)
- 进入肺系统
- 穿过内皮细胞的紧密连接
纳米颗粒可以通过三个主要途径进入人体;注射、吸入或口服为了开发“理想的”基于纳米颗粒的输送系统,你必须首先确定身体将如何处理外源性颗粒物质。如果人体检测到一种纳米颗粒为“异物”,人体的自然免疫反应将导致它被清除出体外——这个问题可以通过改变颗粒的表面特性来解决。通过将聚合物复合物结合到表面,可以防止血浆蛋白的结合(通常会增加清除率)。16
纳米颗粒已被探索作为治疗药物的载体许多疾病,包括癌症、神经系统疾病和获得性免疫缺陷综合症(艾滋病)。
以纳米颗粒为基础的药物递送如何用于杀死癌细胞的一个例子。来源:分子生物科学研究所
脂质体
脂质体是由一个(或多个)磷脂双分子层组成的球形囊泡。17由于这些囊泡具有灵活的生化和物理化学性质,使它们易于操纵,因此它们本身是一种有吸引力的递送系统。18脂质体具有包裹亲脂性和亲水化合物的独特能力,使其成为一系列药物的合适载体。其他优点包括它们的自组装能力、携带大量药物的能力以及它们的生物相容性。由天然磷脂组成,使它们“药理不活跃”,这意味着它们表现出最小的毒性。脂质体可以分为四种主要类型:
- 传统的
- Theranostic
- 聚乙二醇
- Ligand-targeted
值得注意的是,虽然脂质体可以很容易地操纵和修改-修改增加了检测和清除的机会。18
微球
微球是小的(1-1000微米)球形颗粒,19通常由线性聚合物制备,并被描述为“自由流动的粉状药物输送系统”。20.当涉及到它们作为药物输送系统的使用时,它们具有许多有利的性质,包括;可生物降解,生物相容性,易于管理。两者都可以使用本地化而且有针对性的运送药品。药物分散在微球的聚合物基质中。用这两种方法都可以制备微球天然聚合物或合成聚合物.1
合成聚合物可以进一步分类,这取决于它们是可生物降解的还是不可生物降解的。不可生物降解的微球在体内的持续存在会在较长时间内增加毒性的风险。然而,生物可降解聚合物不会造成同样的风险,使其更适合于肠外应用。1
其他基于载体的方法包括重封红细胞、胞浆体和单克隆抗体。
参考文献
1.Bhagwat RR, Vaidhya IS。新型给药系统综述。国际药学科学杂志。2013; 4(3), 970 - 982。doi:10.13040 / ijpsr.0975 - 8232.4 (3) .970 - 82
2.郝杰,恒平。口腔给药系统。药物开发和制药, 2003; 29(8), 821 - 832。doi: 10.1081 / ddc - 120024178
3.Smart J.口腔给药。专家Opin药物输送。2005; 2(3), 507 - 517。doi:10.1517 / 17425247.2.3.507
4.鼻腔给药-最新进展及未来展望。J控制释放。2012, 161(2), 254 - 263。doi:10.1016 / j.jconrel.2012.01.024
5.Zomig 5mg鼻喷雾剂-患者信息传单(PIL) - (eMC)。(2019)。2019年7月19日访问。https://www.medicines.org.uk/emc/product/6712/pil
6.库布利克H,维格伦M.鼻腔输送系统及其对沉积和吸收的影响。药物输送。牧师。1998; 29(1 - 2), 157 - 177。doi:10.1016 / s0169 - 409 x (97) 00067 - 7
7.王晓明,王晓明,王晓明。眼给药方法。aap J。2010; 12(3), 348 - 360。doi:10.1208 / s12248 - 010 - 9183 - 3
8.Inamuddin, Asiri, A., & Mohammad, A.(2018)。纳米复合材料在药物输送中的应用(pp. 509-573)。瑞斯出版社出版。
9.阴唇N,多洛维奇m,肺部给药。第一部分:影响雾化药物疗效的生理因素。Br。j .中国。杂志。2003; 56(6), 588 - 599。doi:10.1046 / j.1365-2125.2003.01892.x
10.舌下粘膜作为全身给药途径的研究。Int。j .制药。制药。2011; 3(2), 1822。
11.Alkilani A, McCrudden M, Donnelly R.透皮给药:基于破坏角质层屏障特性的创新药物开发。制药学。2015; 7(4), 438 - 470。doi:10.3390 / pharmaceutics7040438
12.唐纳利R.(2012)。微针介导的透皮和皮内给药。西苏塞克斯郡奇切斯特:威利-布莱克威尔。
13.Alexander N, Baker E, Kaptein M, Karck U, Miller L, Zampaglione E.为什么考虑阴道给药?Fertil。杂志。2004年,82(1),1 - 12。doi:10.1016 / j.fertnstert.2004.01.025
14.Sahoo CK,等。阴道内给药系统概述。点。药物输送2013; 43-55。
15.Svenson S.(2004)。基于载体的药物输送。华盛顿特区:嗨,美国化学学会.
16.李国强,李国强。纳米颗粒系统在药物递送技术中的应用。沙特制药公司。2018年,26(1),64 - 70。doi:10.1016 / j.jsps.2017.10.012
17.Akbarzadeh A, Rezaei-Sadabady R, Davaran S, Joo S, Zarghami N, Hanifehpour Y.等。脂质体:分类、制备和应用。纳米级研究, 2013; 8(1)。doi:10.1186 / 1556 - 276 x - 8 - 102
18.Sercombe L, Veerati T, Moheimani F, Wu S, Sood A, Hua S.脂质体辅助药物递送的进展与挑战。前面。杂志, 2015; 6。doi:10.3389 / fphar.2015.00286
19.Varde N, Pack D.控释药物输送微球。专家意见生物Ther, 2004; 4(1), 35-51。doi:10.1517 / 14712598.4.1.35
20.李志强,李志强,李志强,等。微球在药物传递中的作用。药物Deliv。列托语, 2013; 3(3), 191 - 199。doi:10.2174 / 22103031113039990003



