在寻找新的铅化合物——最新的药物化学的影响的故事

当你不幸被觉得很累的时候,心情不佳或只是头疼,你一个小药丸,一切都恢复正常。使用现有的药物和药物看起来很简单,但是开发新药的过程却绝非易事。新药的发现跨度范围广泛的主题,从基础研究到临床和转化医学发展。药物化学在这些努力中是一个不可或缺的工具。在这里我们将深入探究世界的现代药物化学和学习科学家们不断创新找到药物的候选人和得到最好的市场,在你手中。
药物发现管道
2018年,美国食品和药物管理局批准59新药广泛的条件。1这些成功的故事药物开发管道大致可以分成三个阶段:
1。基础研究
目标的发现和验证是第一步,一个基因,蛋白质或蛋白质相互作用2disease-pertinent函数确定。其次是铅化合物的识别和优化。“领导”是一个复合显示一些药理或对目标生物活性,和形式的起点的发展最终的药物。此外,必须开发一个合适的试验筛选和衡量合成化合物的影响。
2。发展
发展阶段是指临床前安全性研究和临床试验。临床前开发可能包括药物动力学和毒性研究动物遗传毒性研究或组织生物标记的识别。这在人类临床试验开始的高潮。有三个阶段:第一阶段(评估药品安全剂量范围和识别副作用),二期(评估疗效)和第三阶段(目标符合药品有效性和监测副作用)。如果复合完成所有三个阶段,然后它可能被认为是监管部门的批准。
3所示。生命周期
最后阶段,药物获得监管部门的批准后作为一个新的实体,是生命周期管理或所谓的上市后监管。在上市后监测药物是安全或罕见的严密监控和普通人群的长期负面影响。
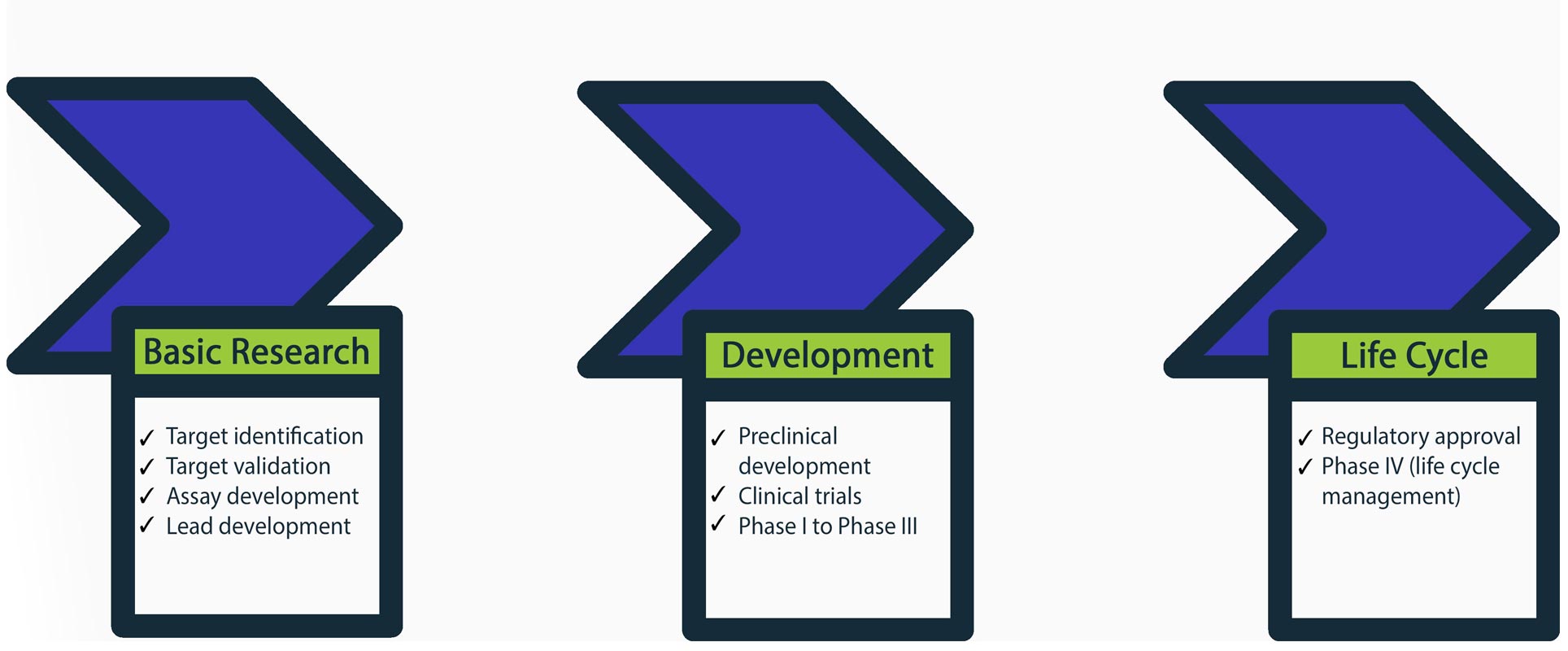
图1所示。药物开发管道。
建筑一座天然的图书馆
有许多可能的来源的铅化合物和一个可以屏幕上成功的机会就越高。获得的化合物可以通过筛选确定大型图书馆的帮助下经典组合化学3或在网上采用计算机建模。这里最著名的方法是基于机器学习和深入学习。4
另一种方式是接触自然,它以其丰富的生物多样性总是能够提供意想不到的新化学和生物学。然而,尽管植物和微生物容易产生这些化学物质,他们在实验室里合成是很困难的。结构太复杂,传统的有机化学。这就是为什么巴塞尔大学的研究人员,瑞士,自然生成的一个巨大的图书馆重点,“索引”DNA的帮助。
重点是化合物,环大小为12或更多的原子特性。因为执行preorganization macrocycle环结构和与多个结合位点的能力这些化合物通常具有良好的药代动力学性质。有趣的是目前在100 macrocycle-based来源于天然产物的药物。5
一项研究发表在《应用化学国际版,6描述了一个七步化学合成的DNA编码macrocycle应承担的图书馆。图书馆使用策略,创建包含环支架多样性元素(构件包括例如烷基芳香或heteroaromatic)半个split-pool合成。在这种方法中,这是一个替代平行合成、图书馆第一次分裂,再加上积木,然后汇集,清洗和deprotected,紧随其后的是新一轮的分裂和耦合。该研究的作者成功地以这种方式生成140万个分子。重要的是,每个化合物库中包含一个共价结合DNA标记编码如何。多亏了这个聪明的花招,整个图书馆可以检查在一个相对简单的实验。作者确实执行屏幕对两个蛋白质目标人血清白蛋白(HSA)和α1检测酸性糖蛋白(AGP)。
”有一个很大的收集不同的重点可用于筛选,更丰富的数据调查这些非凡的分子可以开始”的属性,丹尼斯吉林厄姆教授说,他是该研究。“这可能会揭示未来医药应用中,目标或活跃的原则。”
确定下一个最佳临床候选人——更快

从突变到治疗
在高通量筛选是许多药物的起点,蛮力方法并不总是必要的。有时找到正确的目标,开发一个好的机械对该病的了解就是答案。这是ALK2抑制剂的故事。
ALK2(激活素受体kinase-2)是一种丝氨酸/苏氨酸激酶基因的产物ACVR1。的蛋白质部分骨形态形成蛋白通路以及转化生长因子β(TGFβ)信号途径。科学家们发现,童年ALK2涉及一群是致命的肿瘤被称为漫射内在脑桥的神经胶质瘤(DIPGs)。具体来说,经常性的体细胞突变基因存在于DIPG病人的四分之一。7
“DIPG是一种相对少见的儿童的大脑癌症,但它总是致命的。学习更多关于DIPG的生物学,并试图找到方法来将这些知识转化为新的治疗方法,多年来一直我的激情。我的实验室发现的突变ACVR1DIPG癌症基因发生在一个季度,这是令人难以置信的看到这现在可以导致疾病的潜在新药。我迫不及待地想看到他们如何执行的病人,”克里斯·琼斯教授说,小儿脑瘤的生物学教授癌症研究学院,伦敦。
事实上,最初发现使研究者合成一系列新型的quinazolinone-containing ALK2抑制剂。8》中发表的研究中写道医药化学杂志组癌症研究所(ICR),伦敦,执行系统的交叉筛选及构效关系研究(SAR) quinazolinone衍生品增加达到40 - 80倍力量在最初的冲击。然后他们获得的一些化合物的晶体结构绑定到ALK2。当一个化合物的绑定的方式与之前的假设一致,另一个显示了绑定模式。尽管翻转绑定,这些化合物仍然保持他们的力量。
这是一个起点,形成更高级的抑制剂。
几年后,另一项研究从只有两个ALK2抑制剂磨练,pyrazolo(1、5)嘧啶ldn - 193189和吡啶ldn - 214117。作者证明了这些化合物在临床前模型DIPG有有益的影响。9开放的科学M4K制药公司现正积极开发药物箍筋带他们进入临床试验在不久的将来。
“这是一个重要的研究完全说明获得详细了解癌症的生物可以让我们很快的发现新的治疗方法——在这种情况下,一场毁灭性的罕见类型的儿童脑癌,”保罗沃克曼教授说,癌症研究协会的首席执行官,伦敦。
随着药物发现进步到新的发展范式,药物化学过程中仍然是一个关键工具。我们现在看到的主要方式的变化进行高通量的屏幕。例如,在下面进行了突出显示,由于DNA-encoded库。其他发展包括更好的自动化和微流体也留下了自己的印记。然而,尽管这些技术进步,深刻理解分子识别原理和结构的知识仍然是必不可少的在指导药物目标识别和优化。一起,这些基因组分析通过大规模的全基因组测序帮助加速新药的交付。
引用
1。药物评价和研究中心,2018新药物治疗的批准。(2018)。
2。Sperandio说道,O。,Reynès, C. H., Camproux, A.-C. & Villoutreix, B. O. Rationalizing the chemical space of protein–protein interaction inhibitors.药物。今天15,220 - 229 (2010)。
3所示。刘,R。,Li, X. & Lam, K. S. Combinatorial chemistry in drug discovery.咕咕叫。当今。化学。医学杂志。38,117 - 126 (2017)。
4所示。张,L。棕褐色,J。,Han, D. & Zhu, H. From machine learning to deep learning: progress in machine intelligence for rational drug discovery.药物。今天22,1680 - 1685 (2017)。
5。Ciardiello, J·J。斯图尔特,h·L。痛,h F。,Galloway, W. R. J. D. & Spring, D. R. A novel complexity-to-diversity strategy for the diversity-oriented synthesis of structurally diverse and complex macrocycles from quinine.Bioorg。地中海,化学。25,2825 - 2843 (2017)。
6。压力,c·J。索特,B。,Schneider, L. A., Sharpe, T. & Gillingham, D. A DNA-Encoded Chemical Library Incorporating Elements of Natural Macrocycles.Angew。化学Int。。58,9570 - 9574 (2019)。
7所示。泰勒,k . R。et al。复发性激活ACVR1突变扩散内在脑桥的神经胶质瘤。Nat,麝猫。46,457 - 461 (2014)。
8。哈德逊,L。et al。小说Quinazolinone抑制剂ALK2翻转之间交替绑定模式:结构活性关系,结构表征,激酶分析和细胞的概念。j .地中海,化学。61年,7261 - 7272 (2018)。
9。卡瓦略,D。et al。ALK2 ACVR1的抑制剂在临床前模型显示有益突变体扩散内在脑桥的神经胶质瘤。Commun。医学杂志。2156 (2019)。

