亚硝胺在药物杂质

2018年,亚硝胺杂质(N-nitrosodimethylamine或“NDMA”)中检测出几个包含活性成分缬沙坦的药物,导致一个自愿的产品回忆。这些杂质的意想不到的发现随后引发新的生产要求这些药物的发展,和制药公司不得不采取预防性措施,减轻生产的风险在药物合成亚硝胺。
这里,我们仔细看看亚硝胺,它们是如何创建的,相关的健康问题和示例的亚硝胺杂质被发现。
亚硝胺是什么?
也称为亚硝胺,亚硝胺具有亚硝基的(-)组在氮,硝酸盐或亚硝酸盐反应时形成的二级或三级胺。
虽然在某些食物(如亚硝胺存在。肉类、乳制品和蔬菜)和饮用水供应在低水平,他们的存在在医药产品被认为是,监管机构,是不可接受的。
健康问题是什么?
亚硝胺杂质已经被证明是可能的人类致癌物,基于动物研究,因此被认为是一个健康问题。
二甲基亚硝胺(静),通常被称为NDMA、首次报道在老鼠致癌,麦基和巴诺在1956年的一项研究。静了男性和女性的饮食白化病老鼠。在大鼠静,作者报道,“发生肝肿瘤的发病率非常高,许多与转移性传播”。
后续的工作 麦基和巴恩斯在1967年确认了一些额外的亚硝基的化合物是致癌的,包括 N-nitrosodiethylamine (NDEA)。NDEA和NDMA 显示导致肿瘤 在一些种类的动物,在不同的组织的网站,通过接触不同的路线。

自NDEA NDMA(图1)中列出在1981年第二次年度报告的致癌物质使用各种临床前模型执行的,额外的研究进一步证明他们的致癌特性。
更多信息的致癌效应NDEA, NDMA和其他可以发现亚硝胺在这里。
亚硝胺被认为是“已知的诱变致癌物”(第1类杂质)我M7 (R1)指导方针。
亚硝胺形成的潜在原因
欧洲药品局(EMA)列出了几个潜在的原因亚硝胺的存在的药品:
- 使用亚硝酸钠*的二级或三级胺或季铵盐在相同的或不同的流程步骤(如果移行可能发生)。
- 使用亚硝酸钠*结合试剂、溶剂、催化剂、容易降解的二级或三级胺,在相同的或不同的流程步骤(如果移行可能发生)。
- 使用被污染的原材料的活性药物成分(API)制造过程。
- 使用回收材料(如溶剂)包括恢复外包给第三方不知道内容的材料加工,和常规复苏过程中非专用设备。
- 使用受污染的起始原料和中间体使用过程或由供应商提供的原材料,可以允许亚硝胺的形成。
- 由于不同的进程运行在交叉污染事件相同生产线和由于operator-related错误。
- 退化过程的起始原料、中间体和药品物质,包括那些引起的固有反应结合遗留的亚硝酸钠*(成品配方或存储期间可能发生)。
- 使用特定的包装材料。
*或其他nitrosating代理
每日摄入量限制亚硝胺
众多的监管机构,包括美国食品和药物管理局(FDA)制定国际公认的日摄入量限制亚硝胺(表1)。如果一个批准的药物发现含有亚硝胺的水平高于每日允许摄入量限制,FDA建议药物被召回。FDA还建议“亚硝胺杂质可能增加患癌症的风险如果人们暴露在他们可以接受的水平之上,在很长一段时间。”
表1:临时许可每日摄入量限制对亚硝胺杂质。
| 化学名称 | 缩写 | 每日允许摄入量(AI) |
| N-nitrosodimethylamine |
门冬氨酸 | 96.0 ng /天 |
| N-nitrosodiethylamine |
NDEA | 26.5 ng /天 |
| N-nitroso-N-methyl-4-aminobutyric酸 |
NMBA | 96.0 ng /天 |
| N-nitrosodiisopropylamine |
DIPNA | 26.5 ng /天 |
| N-nitrosoethylisopropylamine |
EIPNA | 26.5 ng /天 |
根据世界卫生组织(世卫组织)实例中亚硝胺在医药产品验明正身,监管机构应采取以下步骤:
- 确认中亚硝胺含量的确定产品,使用国家测试实验室或从供应商自己交代问题。应该使用合适的测试方法。
- 要求产品的营销授权持有者(mah)进行风险评估识别/ s亚硝胺污染的原因和实施限制,以确保杂质低于以受控的方式可以接受的水平。
- 请求mah实现保证未来的亚硝胺水平变化本质上是缺席。
几种不同的方法来确定亚硝胺杂质已经发表的美国食品药品监督管理局和官方药物控制实验室(OMCLs)网络欧洲委员会。
非常挑剔和敏感的方法量化亚硝胺的缬沙坦药物物质

缬沙坦和其他相关“sartan”药物经常用于治疗高血压或心力衰竭患者。然而,自2018年以来,数以百计的回忆已经发放给了sartans由于污染水平不可接受的亚硝胺,一群基因毒性的化合物。少有效的亚硝胺监视可以帮助确保这些昂贵的产品召回,和不必要的病人接触。下载这个程序注意发现量化sartans亚硝胺含量的方法。
下载应用程序注意赞助内容
受到亚硝胺杂质什么药?
到目前为止,已发现亚硝胺杂质在下面列出的各种药物,随后被某些制造商召回。
血管紧张素ⅱ受体拮抗剂(arb)缬沙坦、Irbesartan和洛沙坦
血管紧张素ⅱ受体阻滞剂属于一类降压药。他们是用于治疗高血压和心力衰竭 选择性地抑制血管紧张素ⅱ结合血管紧张素ⅱ受体的肌肉 周围血管,导致膨胀和减压。
缬沙坦
2018年7月13日,FDA发表 新闻稿 宣布自愿召回数包含缬沙坦的药物,由于杂质被发现。NDMA杂质。2018年7月27日,FDA发布信息NDMA在召回产品的水平。他们还透露,据记录由制造商提供,一些亚硝胺杂质的水平可能是出现在医药产品只要四年。
2018年9月13日,FDA宣布 一个额外的已经检测到杂质(NDEA) 在三个很多产品召回缬沙坦。这引发额外的召回产品重新测试和其他的测试目前销售药物NDEA的存在。
Irbesartan
2018年10月30日,美国食品和药物管理局 发布 自愿召回的一份声明中警告某些很多irbesartan,因为NDEA杂质被发现。这是第一个non-valsartan产品检测到该机构包含NDEA杂质。
洛沙坦
2019年3月1日,美国食品和药物管理局 报道 发现NMBA在特定很多洛沙坦和87年宣布,很多药物被召回。后当天另一个版本 发布 宣布额外的洛沙坦产品召回由于NMBA杂质的存在。新闻稿是 发布 2019年4月和6月期间,提醒病人和医护人员进一步召回洛沙坦的产品。
FDA可用了 更新的列表 的所有血管紧张素ⅱ受体拮抗剂回忆道。
亚硝胺测定杂质在洛沙坦钾药物使用三重四极质物质
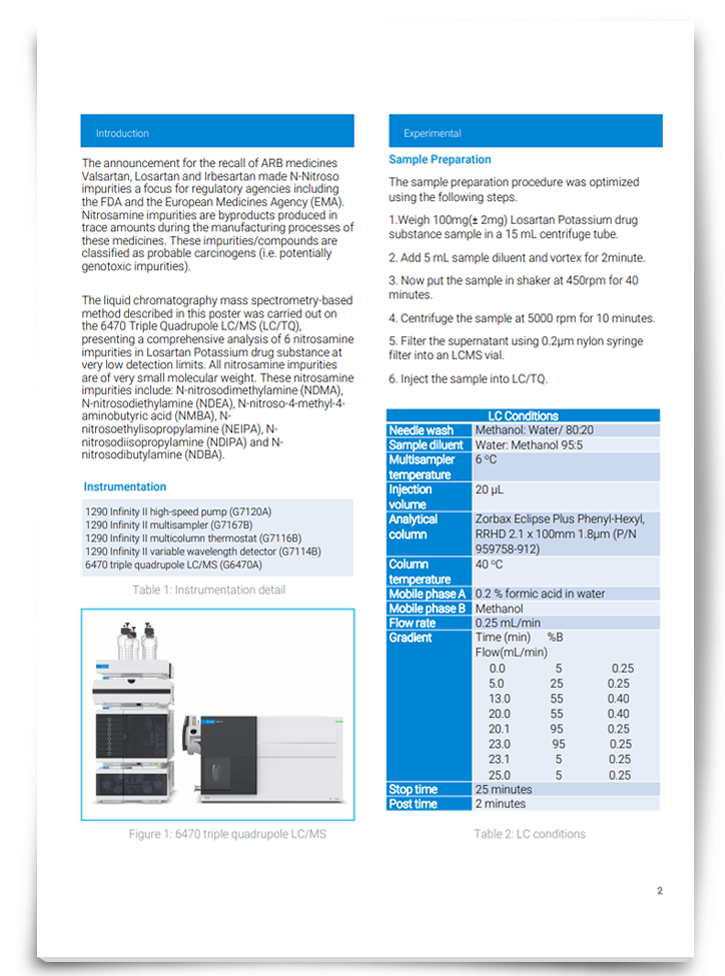
亚硝胺杂质在生产过程中副产品中产生微量的血管紧张素受体阻断(ARB)的药物。然而,这些杂质已经被归类为可致癌物质,所以他们的发现,顺向召回ARB药物,如洛沙坦N-Nitroso杂质很多监管机构关注的一个焦点。下载这个海报发现一种方法可以提供一个综合分析亚硝胺的杂质。
下载的海报赞助内容
雷尼替丁和nizatidine
雷尼替丁的药物是一种快速的 组胺H2受体拮抗剂。它 的工作原理是 抑制胃酸的分泌,降低酸的体积和胃蛋白酶分泌的内容。Nizatidine是一个有效的组胺H2受体拮抗剂和雷尼替丁在类似的方式工作。
2019年9月13日,美国食品和药物管理局 发布 一份新闻稿中宣布NDMA杂质被发现在一些雷尼替丁药物。在相同的日期 EMA宣布 它将开始审查药品检测后NDMA雷尼替丁。在接下来的几个月, 额外的版本 发行宣布自愿召回的雷尼替丁吗和nizatidine产品。
美国食品和药物管理局已 实验室分析 雷尼替丁和nizatidine产品可用。
二甲双胍
二甲双胍是用来 治疗2型糖尿病 饮食和锻炼时,尤其是在超重的人,就不会导致足够的血糖控制。 它通过 降低基础和餐后血糖。
2019年12月5日,FDA发布了一个 声明 简妮特,医学博士,FDA药物评价和研究中心主任,与低水平的的发现DNMA二甲双胍药物中的杂质 以外的美国。一个月后 EMA承认存在 非欧盟二甲双胍药物含有微量的NDMA。
2020年5月28日,FDA宣布 NDMA杂质超过可接受的摄入量限制被检测到 在很多很多的延长释放(ER)二甲双胍的配方。2020年6月,美国食品和药物管理局提醒病人和卫生保健提供者 五公司主动召回 某些ER二甲双胍的产品。
美国食品和药物管理局已实验室分析二甲双胍的产品可用。


