利用蛋白质降解目标无药可治的

阅读时间:
一个蛋白质的生活
蛋白质合成基于信使rna模板在翻译的过程中,发生在一个细胞器被称为核糖体(图1)。核糖体核糖核蛋白复合物,被发现在细胞溶质或与内质网(ER)有关。翻译后,新产生的蛋白质折叠成它们的原生结构,通常在监护人的帮助下,运送到他们的目标细胞室。
蛋白的半衰期不同范围可以从分钟甚至数年,也见过一些组件的细胞外基质。当蛋白质降解,它们分解通过两个主要航线:
- 分泌蛋白和血浆内源性和贩卖到溶酶体膜蛋白,通过溶酶体降解蛋白酶。这些蛋白酶也起到一定的作用在微,macro-autophagy蛋白水解降解。
- 另一个蛋白质降解途径是ubiquitin-mediated。蛋白酶体依赖降解
在本文中,我们将讨论ubiquitin-mediated和蛋白酶体依赖降解的机理讨论如何用来设计新的疗法,可以把人类蛋白质到治疗目标的任何类。
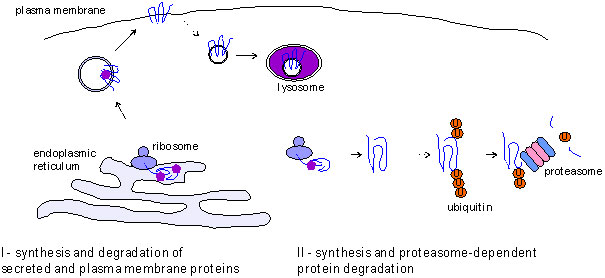
图1所示。蛋白质(来源:Proteintech)的生活左:分泌和等离子体膜蛋白合成核糖体与ER和退化主要在溶酶体通过内吞作用的路线。右:细胞内蛋白质合成在细胞质中的核糖体和遵循ubiquitin-mediated水解酶降解。
泛素和proteasome-dependent退化
泛素是一个小~ 9 kda蛋白质,存在于几乎所有的人类细胞,通常在形式的多聚体或与其他蛋白质。与泛素结合的蛋白质是ubiquitin-mediated。蛋白酶体依赖降解的基础这是一个高度管制机制,包括三种类型的酶(图2)。
这个反应的引发剂是ubiquitin-activating酶E1,泛素的生产活动thiolester形式。E2 ubiquitin-conjugating酶激活泛素结合,E3连接酶新兵针对退化和介导的细胞蛋白质泛素的转移靶蛋白的赖氨酸残基。在大多数情况下,这个过程是周期性的,导致泛素链的延伸,因为泛素分子也拥有一个赖氨酸组。然后polyubiquitinated蛋白质被26 s蛋白酶体,multimeric复杂组成的一个20多岁的核心和19 s调节粒子出席一个或两个目的。19世纪粒子识别polyubiquitinated蛋白质为基质,而20年代核心执行蛋白质降解。
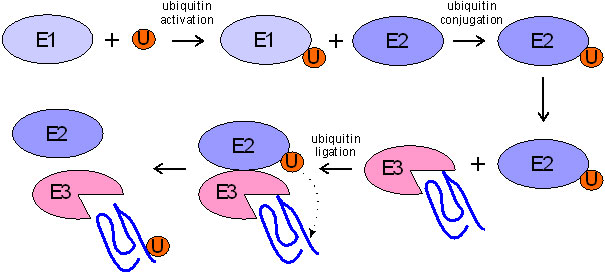
图2。蛋白质泛素化(来源:Proteintech) E1一连串的泛素激活酶,结合酶E2和泛素连接酶E3负责泛素分子的转移到靶蛋白。
PROTACs- - - - - -使用E3-ligase-mediated蛋白质降解的药物
针对嵌合体蛋白水解作用(PROTACs)是一种新的疗法,采用有针对性的蛋白质降解作用方式。他们组成的两个领域——一个绑定域目标蛋白质和配体的E3连接酶招聘(图3)。协会与靶蛋白和PROTACs E3-ubiquitin连接酶复杂带来的机械在靠近目标蛋白质降解,导致其后续polyubiquitination。然后被ubiquitinated靶蛋白26 s蛋白酶体域和proteolytically消化。在整个过程中,PROTACs作为催化剂,不是退化;因此,他们尤其有效,因为它们仍然能够促进随后的许多分子靶蛋白的泛素化。
第一代PROTACs肽来源于自然的E3连接配体用于他们的招聘6、7 提供所需的活动,但通常不是细胞渗透,或要求微摩尔的浓度为效率目标退化。转向使用设计小分子E3连接酶配体降低他们的分子量,改善细胞渗透性和效力 。1、2

图3。的作用机制PROTACs(来源:Proteintech) PROTACs调解靶蛋白间的相互作用和E2-E3复杂,允许泛素的转移到靶蛋白。PROTACs蛋白质目标包括核受体(例如AR)转录因子(例如ARNT)激酶(例如HER2)和脚手架蛋白(例如BRD9)。Immunofluorescent分析10%甲醛固定HepG2细胞使用22576 - 1 - ap (雄性激素受体抗体)在1:50的稀释。白平衡的结果ARNT (HIF1B)据美联社;抗体(14105 - 1 -1:3000;孵化在室温为1.5小时)和sh-Control sh-ARNT (HIF1B)转染海拉细胞。18299 - 1 - ap (HER2 / ErbB2稀释的抗体)1:6 00(40岁以下x镜头)热抗原介导的检索与Tris-EDTA缓冲区(pH9)。海拉细胞受到SDS页面之后,免疫印迹与24785 - 1 - ap (BRD9稀释的抗体)1:1000孵化在室温为1.5小时。
PROTACs超过其他形式的优点
一般来说,两个最常见的类型的疗法是小分子和单克隆抗体(mab)。小分子很好搭配衣服,可以作用于细胞外和细胞内的目标,不像马伯主要目标细胞外蛋白质如细胞受体(表1),小分子和马伯主要法案通过绑定到目标分子为了影响给定的结果——例如,防止其活性,抑制绑定与其他合作伙伴或激活某些途径。马伯通常提供高特异性较低的毒性,这通常是难以实现与小分子药物的候选人。另一方面,小分子通常有更好的组织渗透由于分子量低,半衰期短,短的药效学。小说形式,如抗体药物配合(adc)或Fc-fusion蛋白质努力克服这些挑战。然而,他们不能克服的主要障碍:他们不显著扩大蛋白质类制药的这些模式。
PROTACs的作用机理是基于选择性结合靶蛋白触发其催化降解。与其他模式,结合位点不必仅限于特定的蛋白质域,如活动网站的酶与底物或蛋白质交互网站阻止绑定。
从理论上讲,任何网站在蛋白质表面可以通过PROTACs只要有针对性的提供了给定的分子特异性。这也提供了一个很大的优势在小分子选择性地针对突变蛋白或蛋白亚型。一个有趣的概念是使用目标蛋白结合域功能只在某些细胞的国家——例如phosphoPROTACs只活跃在磷酸化状态 。3因为PROTAC作用机制涉及目标蛋白质的催化降解,PROTACs可以针对脚手架蛋白,non-enzymatic目标蛋白质间交互作用或者有毒蛋白质聚合。即使是低剂量的药物应该足够的行动。
表1。比较药物小分子的性质,抗体和PROTACs。
| 功能 | 小分子 | 抗体 | PROTACs |
| 细胞外的目标 | 是的 | 是的 | 没有 |
| 细胞内目标 | 是的 | 没有 | 是的 |
| 支架蛋白的目标 | 有限的 | 没有 | 是的 |
| 目标蛋白质间交互作用 | 有限的 | 有限的 | 是的 |
| 针对突变蛋白/蛋白亚型 | 有限的 | 有限的 | 是的 |
| 的作用机制 | 绑定触发抑制/激活目标 | 绑定触发抑制/激活目标 |
绑定和催化降解的目标 |
| 大小 | 小(小于1 kDa) | 大(ca 150 kDa)。 | 中小(小分子PROTACs 1.5 kDa) |
| 半衰期 | 通常时间 | 几天到几周 | TBD |
| 药效学 | 短的表演 | 长期代理 | TBD |
| 剂量 | 每天 | 断断续续的 | TBD* |
| 选择性 | 有限的 | 高 | 高 |
| 组织渗透 | 好 | 有限的 | 好 |
*预测小分子相比,低剂量
PROTACs的未来
PROTACs无疑有潜力改变药物发现景观在即将到来的年。原理研究已经证明他们对各种蛋白质降解活动目标,包括核受体、转录因子、激酶、脚手架蛋白在细胞实验中(图3)。第一个PROTAC分子现在达到临床的发展阶段。当前努力专注于发现和改进现有的E3连接酶连接器和获得更好的理解三级复合物之间的目标蛋白质破解驱动目标退化。例如,它最近表明PROTACs设计目标图案出现在许多蛋白质可以成功地与绝大多数的他们,但引发退化的只有一小部分 。4目前,没有在网上模型能正确地预测成功。其他专注于改善细胞渗透性PROTACs通过改变配体和重新设计连接器。一个有趣的方法是提供两个PROTAC前兆,组装成一个功能PROTAC分子细胞内使用点击化学(所谓的CLIPTACs )。5
引用
- 对此,d . P。母马,。,Smith, I. E. D., Ko, E., Campos, S., Miah, A. H., Mulholland, K. E., Routly, N., Buckley, D. L., Gustafson, J. L., Zinn, N., Grandi, P., Shimamura, S., Bergamini, G., Faelth-Savitski, M., Bantscheff, M., Cox, C., Gordon, D. A., Willard, R. R., … Crews, C. M. (2015). Catalytic in vivo protein knockdown by small-molecule PROTACs.化学生物学性质,11(8),611 - 617。https://doi.org/10.1038/nchembio.1858
- 巴克利,d . L。Raina K。,Darricarrere, N., Hines, J., Gustafson, J. L., Smith, I. E., Miah, A. H., Harling, J. D., & Crews, C. M. (2015). HaloPROTACS: Use of Small Molecule PROTACs to Induce Degradation of HaloTag Fusion Proteins.ACS化学生物学,10(8),1831 - 1837。https://doi.org/10.1021/acschembio.5b00442
- 海恩斯,J。,Gough, J. D., Corson, T. W., & Crews, C. M. (2013). Posttranslational protein knockdown coupled to receptor tyrosine kinase activation with phosphoPROTACs.美国国家科学院院刊》上,110年(22),8942 - 8947。https://doi.org/10.1073/pnas.1217206110
- 黄,H.-T Dobrovolsky D。珀克,J。杨,G。,Weisberg, E. L., Doctor, Z. M., Buckley, D. L., Cho, J.-H., Ko, E., Jang, J., Shi, K., Choi, H. G., Griffin, J. D., Li, Y., Treon, S. P., Fischer, E. S., Bradner, J. E., Tan, L., & Gray, N. S. (2018). A Chemoproteomic Approach to Query the Degradable Kinome Using a Multi-kinase Degrader.细胞化学生物学,25(1),88 - 99. - e6。https://doi.org/10.1016/j.chembiol.2017.10.005
- Lebraud, H。,Wright, D. J., Johnson, C. N., & Heightman, T. D. (2016). Protein Degradation by In-Cell Self-Assembly of Proteolysis Targeting Chimeras.ACS中央科学,2(12),927 - 934。https://doi.org/10.1021/acscentsci.6b00280
- 坂本,k . M。金,k B。,Kumagai, A., Mercurio, F., Crews, C. M., & Deshaies, R. J. (2001). Protacs: Chimeric molecules that target proteins to the Skp1–Cullin–F box complex for ubiquitination and degradation.美国国家科学院院刊》上,98年(15),8554 - 8559。https://doi.org/10.1073/pnas.141230798
- Schneekloth,约翰。塞卡f . N。Koldobskiy, M。Mandal,。,Deshaies, R., Sakamoto, K., & Crews, C. M. (2004). Chemical Genetic Control of Protein Levels: Selective in Vivo Targeted Degradation.美国化学学会杂志》上,126年(12),3748 - 3754。https://doi.org/10.1021/ja039025z
广告

