用配体表达可视化药物靶点
在治疗药物的开发中,了解分子在体内可能产生的靶向和脱靶效应是至关重要的。这些信息使研究人员能够破译药物的作用机制,确定主要候选药物的优先级,了解副作用,以及确定已经上市药物的新用途。
Cyclica's Ligand Express®是一个基于云的平台,可以根据结构特征蛋白(或“蛋白质组”)筛选小分子药物,以确定多药理特征。该技术通过利用人工智能识别蛋白质靶标,并可视化药物对这些靶标的作用。随后,科学家们能够识别靶内和靶外的相互作用。我们与Cyclica的总裁兼首席执行官Naheed Kurji和首席科学官Andreas Windemuth进行了交谈,以了解更多信息。
Laura Lansdowne (LL):为什么有必要确定潜在治疗靶点在疾病中的确切作用?你能谈谈捕捉临床疾病谱系的重要性吗?
Naheed Kurji (NK)和Andreas Windemuth (AW):为了让病人得到最好的护理标准,药物和治疗剂必须针对疾病的根源,精确到分子水平。由于药物与人体内数十个甚至数百个蛋白质靶点相互作用,因此药物需要针对细胞而不是单一蛋白质靶点的传统模式进行设计。包括癌症、神经系统疾病和遗传疾病在内的复杂疾病需要多种药物,每种药物针对一种不同的蛋白质,并以有效的方式协同工作。了解复杂疾病的驱动分子机制有助于开发靶向与疾病直接相关的蛋白质或途径的有效药物。在Cyclica,我们提供端到端支持平台,允许科学家设计、筛选和个性化药物,同时检查多个目标。这种全面的药物设计方法对于创造靶向体内相关蛋白质的药物,同时避免不良后果至关重要。我们同样专注于通过整合基因组数据元素,特别是单核苷酸变体和多态性数据,在我们的平台上推动对结构药物基因组学的深入了解。因此,我们将能够绘制由遗传变异引起的药物反应差异的物理分子相互作用。这是实现精准医疗的关键一步,精准医疗是一门基于对特定疾病的遗传理解为患者开发治疗方法的学科。
今天李华学了两个常用语:传统的药物研发方法为什么会失败?
NK和AW:如今,将一种药物推向市场需要大约13年时间,成本约为26.5亿美元,这意味着在过去50年里,生产效率下降了80倍。根据Shih等人2017年《自然评论》的一篇文章,“药物研发(R&D)成本的最大单一贡献者是高项目流失率。减员是由于各种原因造成的,包括疗效不足、毒性和战略原因。”高减损的一个关键原因是,传统的药物研发专注于设计或筛选与单一靶点相互作用的最佳药物。药物设计的传统分子建模方法,或筛选方法,如高通量筛选(HTS)或虚拟筛选(VS),从单个生物靶点开始,然后筛选一个药物库,以确定那些与该靶点相互作用的药物。虽然这些方法很有用,但它们只能让科学家们走到目前为止。现在人们已经很清楚,药物与体内许多蛋白质相互作用,一些研究估计有30到300种相互作用,其中许多是事先不知道的。虽然狭窄的方法为科学家提供了一个与已知靶标相互作用的假定候选药物的较短列表,但它没有为他们提供药物在体内的其他作用的更广泛的图景,即药物与其他蛋白质相互作用,这被称为多药理学。揭示多药理学的实验方法(例如:CETSA或其他质谱方法)仅限于湿实验室分析的可用目标,因此不能扩展或揭示以前未知的信息。这一科学和技术差距是Cyclica看到的机会,也是导致公司成立和Ligand Express®开发的原因。 Recent advancements in applying deep learning to conventional VS through convolutional neural networks (CNN) have emerged as noted byRagoza等2017年,他们介绍了开源工具,但也对这种方法提出了实质性的担忧。Ragoza等人发现,由于可用数据太有限,经过公开数据训练的CNN增强VS技术难以提供价值。在任何情况下,没有任何可用的基于CNN的方法(Ragoza等,2017,Wallach et al., 2015)处理多药理学。
总的来说,制药公司需要一种更快、更便宜的方法来发现和开发更安全、更有效的药物,以满足需求未得到满足的患者。我们坚信,要实现这一目标,我们不仅需要改进现有的方法,还需要创新新颖的端到端使能技术,在发现管道的多个阶段驱动价值。重要的是,这些技术必须增强内部工作流程,并提高科学家如何更快、更便宜地做出“去”和“不去”的决定。
脱靶相互作用是什么?它们对药物的发现和开发过程有什么影响?
NK和AW:脱靶相互作用本质上是与超出药物预期治疗靶点的蛋白质的生物学改变相互作用,这通常会导致意想不到的和不希望的副作用。如上所述的以目标为中心的传统模型没有考虑到这些导致成本、时间和工作增加的脱靶交互。这种药物可能有数百种脱靶相互作用的现象被称为多药理学。在药物研发过程的后期(已经花费了数亿美元)发现毒副作用,可能会导致巨大的挫折,并增加患者的风险。专注于多药理学的方法是一个关键的转变,通过将细胞视为一个整体来设计药物,而不仅仅是一个单一的蛋白质。越来越多的文献表明,考虑到疾病的复杂性和可能导致不良反应的不必要的相互作用,多药理学的重要性日益增加。在Cyclica,我们有一种计算方法和多药理学哲学,它们共同提供了对分子作用机制的洞察,探索药物计划的新靶点,重新利用现有药物用于新适应症(即新靶点),并设计多靶点药物,在分子水平上解决疾病谱系。
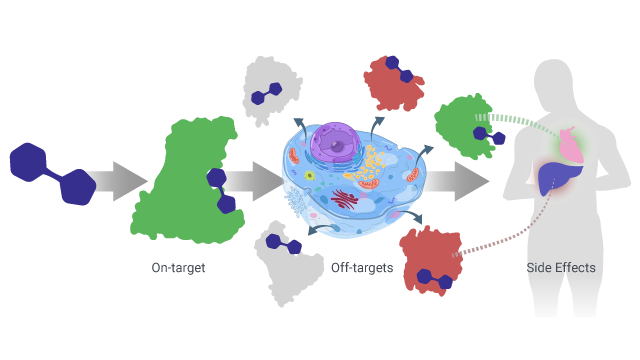
莫莉·坎贝尔(MC):如何利用人工智能来可视化预测的药物-蛋白质相互作用组?
NK和AW:在Cyclica,我们坚信人工智能(AI)在未来的药物发现、加速研发创新和提高生产力方面发挥着至关重要的作用。人工智能将为科学家提供新的信息,使他们能够提高自己的表现水平,并以更快的速度处理信息。然而,人工智能不会成为解决问题的灵丹妙药,也肯定不会取代科学家。我们相信,生物物理学和人工智能的结合将彻底改变药物发现,并将范式从经典的单靶点相互作用转变为基于细胞的整体药物设计。人工智能在增强生物物理学和化学信息学方法时最有用。我们基于云的平台Ligand Express被制药公司的科学家用于支持他们的工作,并提供集成的工作流程。通过MatchMaker™(一种基于结构和人工智能增强的技术,为配体表达提供动力),科学家可以在分子水平上揭示药物如何与靶标相互作用,并通过人工智能进一步了解这些数据,以预测调节效应。Cyclica的人工智能由药物-蛋白质相互作用信息支持,再加上系统生物学,将蛋白质与功能、疾病和其他小分子联系起来。
MC:蛋白质组学的进步是如何支持Cyclica公司技术的发展的?
NK和AW:蛋白质组筛选存在一定的挑战,其中最主要的是计算的复杂性。然而,在过去的几年里,计算能力和机器学习算法有所提高,这在很大程度上依赖于现有的药物结合相互作用知识,并提供了对蛋白质边缘百分比的见解。在Cyclica,我们通过将计算化学和大数据结合起来,专注于蛋白质组范围的筛选,解决了这个问题。我们专有的Ligand Express MatchMaker™技术可评估小分子与数千种蛋白质结构之间相互作用的可能性。以前,由于缺乏蛋白质的结构数据,蛋白质组筛选方法被认为是有问题的。现在,80%的蛋白质组都有相关的结构数据,甚至更多的蛋白质组正在以指数级的速度生成。随着数据的进步,我们可以针对所有已知的结构特征的人类蛋白质筛选小分子,从而全面、全面地了解药物在体内的作用,以及整个蛋白质组的靶上和脱靶相互作用。
MC: Cyclica是如何帮助科学家推进药物研发领域的?
NK和AW:我们的平台Ligand Express是一个基于云的、集成的、端到端使能平台,制药公司的科学家使用它来加速他们的药物发现工作。Ligand Express的愿景是成为制药研发价值链中的一个完整的实用平台,并以协作的方式支持科学家的工作。我们相信,正是这种集成的工作流程将使科学家、生物化学家、医学化学家等能够在药物发现方面做出有效的决策。与科学家一起,我们相信我们的技术可以用来理解大量的现有数据。例如,我们使用专有的人工智能方法建立了一系列预测ADMET模型,以促进小分子转化为药物。与传统分类器相比,该技术已证明可以提高生成ADMET的预测准确性在这里).因此,Cyclica的平台、配体快车和预测ADMET技术可以帮助科学家做出明智的决策,从而降低下游成本和潜在风险。
Naheed Kurji和Andreas Windemuth接受了科技网络科学作家Laura Elizabeth Lansdowne和Molly Campbell的采访。188金宝搏备用



