加快努力重新利用已批准的COVID-19药物
阅读时间:
美国国防高级研究计划局(DARPA)向哈佛大学威斯研究所拨款1600万美元,用于帮助快速寻找fda批准的有望治疗COVID-19的药物。COVID-19是由新型冠状病毒SARS-CoV-2引起的疾病。
“Wyss研究所正在与世界一流的合作者合作,以确定、测试和验证fda批准的可用于预防或治疗COVID-19的药物,”Wyss研究所首席高级科学家Ken Carlson博士说。已经建立了一个药物测试管道,利用三个实验室的专业知识哈佛大学Wyss研究所,位于西奈山的伊坎医学院的tenever实验室,以及马里兰大学医学院弗里德曼实验室.拥有多种技能的研究团队,包括机器学习、组织工程和传染病,已经聚集在一起,努力确定已经通过基因测试的药物药物开发过程并已获得其他适应症的监管批准。
Wyss研究所的项目负责人兼首席研究员Donald E. Ingber医学博士继续评估许多药物,弗里德曼实验室使用SARS-CoV-2病毒进行高通量细胞分析,以测试先导化合物。
Ingber说他们做到了发现了多种抑制培养细胞感染SARS-CoV-2的药物。然而,他建议,当以临床相关剂量使用时,只有这些药物的一个子集也能抑制表达SARS-CoV-2 Spike蛋白(使病毒进入的蛋白质)的工程病毒的感染。
然后最有希望的候选药物被转移到tenOever实验室,在进行临床测试之前确认它们的活性。
“我的团队负责在生物安全3级条件下,在SARS-CoV-2动物模型中测试所有精选药物。为了达到这个目的,我们使用了两种自然易受病毒感染的宿主,包括雪貂和仓鼠,”Benjamin tenOever博士解释说。
但为什么要重新定位呢?
“最大的优势是速度,”威斯研究所创始主任Ingber解释说。
这些药物已经被监管机构认为是安全的,并已在临床使用中得到验证。Ingber继续说:“它们的剂量和配方已经制定出来,一旦我们在临床前模型中提供了有效性的证据,就可以立即启动人体临床验证研究。”
与。相比,重新利用具有显著缩短时间的潜力标准药物开发在美国,它可能需要数年时间才能在各种临床前研究中证明有效性和安全性在体外而且在活的有机体内研究——这只是药物开发的早期阶段之一。一旦你收集了足够的临床前数据,你必须向美国食品和药物管理局提交一份研究性新药(IND)申请,以获得进入临床开发阶段的许可。
“通过使用fda批准的药物,我们已经知道这种化合物在人体内是如何代谢的,以及在什么浓度下使用是安全的。——西奈山伊坎医学院的Benjamin tenOever博士。“这意味着,如果我们找到一种化合物,可以防止感染或降低病毒负担,它可以立即用于人类使用,而不需要漫长的申请IND和进行临床试验的过程。”
在重新利用药物时,我们需要考虑什么?
但是,在考虑这些药物的现有安全数据时,我们需要多小心呢?在以前的研究中获得的数据,用于不同的适应症,在不同的试验人群……
“这是一个非常好的问题,一旦确定了特定的化合物,就需要更详细地考虑这个问题,”他说 tenOever。
通常,临床试验的参与者年龄在18-65岁之间。然而,这项研究也应该以一种反映现实世界中接受治疗的人群的方式设计。鉴于老年人感染COVID-19的风险最高,也许需要考虑这一点。
“如果一种药物没有被批准用于某些人群,那么就需要进行额外的临床研究来验证这些人群的安全性和有效性。此外,如果要将这种药物作为一种治疗药物进行测试(即在已经感染了SARS-CoV-2的患者中进行),那么除了验证疗效外,还需要进行临床研究,以确保使用这些安全的药物不会产生意外的毒性。”Ingber解释说。
重新利用药物-主要好处:
- 这种药物已经通过了整个药物开发流程,这通常需要10-15年的时间。
- 该药物将证明其最初被批准用于的特定适应症具有可接受的安全性和有效性,为研究人员提供额外的见解,如果他们“从零开始”开发一种药物,他们将无法获得这些见解。
- 大规模合成药物是可以实现的,否则,批准治疗是不可能的。
- 被批准的药物将已经有一个健全的生产流程,这意味着药物的供应可以加快。
- 开发这种药物的成本是已知的。
- 将提供关于最佳储存和分配要求的资料。
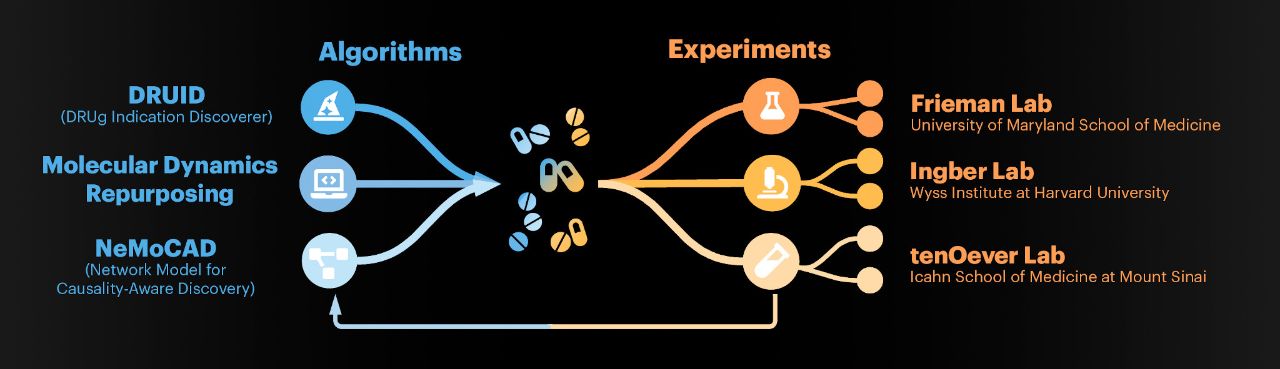
仔细研究正在部署的用于快速评估现有药物对COVID-19的潜在活性的具体方法点击这里.
Donald E. Ingber和Benjamin tenOever接受了技术网络高级科学作家Laura Elizabeth Lansdowne的采访。188金宝搏备用
广告




