端粒酶的三维结构:揭露它在人类疾病中的作用

阅读时间:
研究人员发表第一个详细的图片和描述的端粒酶的三维分子结构——这一发现能够更好的有针对性的药物筛选和可能导致telomerase-related临床疗法更成功。
端粒酶是参与一些人类疾病,包括癌症,异常激活酶导致肿瘤发生。有趣的是,这种酶也是已知的与老化——这是假设的主要原因是由于端粒的损耗。尽管有强大的研究努力确定操纵这种酶的方法,来确定治疗方法对抗这些条件,到目前为止,进展受阻由于缺乏结构信息。
加州大学伯克利分校的科学家们现在报告自然的低温电子显微镜(低温电子显微镜)结构substrate-bound人类端粒酶全酶。
低温电子显微镜substrate-bound人类端粒酶全酶的结构
发现端粒酶的三维结构
在最近的一次新闻稿第一作者Thi黄平君Duong“凯利”阮说:“人类端粒酶的最佳图像的分辨率只有30埃;我们可以得到大约7到8埃分辨率使用冷冻电子显微镜,”
“当我得到了,我可以看到所有的子单元——总共有11个蛋白亚基的时刻,“哇,哇,这是如何结合在一起的。”
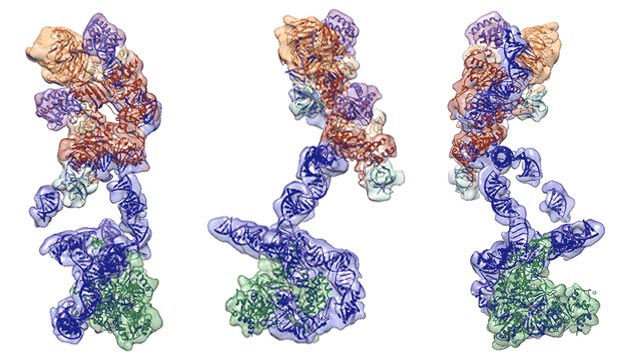
通过优化端粒酶纯化技术和利用低温电子显微镜科学家们能够观察到在subnanometre-resolution端粒酶的结构,“显示端粒酶逆转录酶的催化核心(叔)和守恒的图案的端粒酶RNA (hTR)和H / ACA核糖核蛋白(RNP)。”
在这个决议团队当时能够“适合可用的高分辨率结构和相同型号的所有组件”。这种组合的方法揭示了人类的详细组织端粒酶RNA (hTR)和10个蛋白质亚基组成酶,提供一个清晰的hTR主题功能和基因突变导致端粒酶缺乏症。1
人类端粒酶:它的重要性
2018年的论文的资深作者教授凯瑟琳·柯林斯第一次发表在人类端粒酶的重要性的证据自然纸早在1999年。在他们的原始论文,柯林斯和他的同事们在报告中第一个已知的人类疾病由端粒酶的突变引起的,更具体地说一个突变的蛋白质dyskerin,导致角化病congenita。有这种情况的人高度再生组织的缺陷(如皮肤和骨骼)以及染色体不稳定和发展特定类型的恶性肿瘤的易感性。4
现在,随着更详细的见解在端粒酶的结构,研究人员终于有更好地理解为什么端粒酶蛋白的基因突变在某些导致角化病congenita。突变阻止dyskerin分子之间的联系,防止与其他蛋白质分子从关联网络,以及停止足够的链接到RNA酶的支柱。
凯瑟琳柯林斯解释如何感觉当他们最终发现之间的确切联系角化病congenita和端粒酶:“这对我来说是最好的亮点。的图面板dyskerin突变热点映射到结构冻结——快乐——在我的记忆中从第一作者,凯利阮,先拿给我。只是今天早上我有关这个映射的临床医生dyskerin角化病的基础及其突变热点congenita (Inderjeet Dokal前几个月我的实验室发现端粒酶亚基。
她继续说:“这已经被其他人提出,这些突变削弱dyskerin伴侣SHQ1绑定,但是因为没有SHQ1突变的病人,解释不满意。之前的学生在实验室里努力理解疾病的生化机制(s),所以我很激动,他们工作结合结构解释了为什么端粒酶RNP尤其容易受到疾病的突变。”
端粒酶三维结构解决了:接下来是什么?
伊娃诺加利斯博士,2018年共同通讯作者的自然纸分享更多细节对后续步骤,概述了团队的未来研究重点:“至少有两个重要方向在明年。一个明显的方向是追求真实原子分辨率这一努力将包括把对比的图片我们用电子显微镜获得,所以许多端粒酶分子的形象相吻合的计算分析成一个单一的三维结构可以更准确,从而导致更高的分辨率。
诺加利斯强调图像的数量仍将需要增加十倍或更多——团队的计算分析将不得不变得更加创新的和复杂的。
“原子分辨率将基本定义区域特定于人类复杂的和没有出现在原子结构的非人类的组件对我们到目前为止用于解释密度地图。这一步将使我们能够构建单元的原子分辨率细节交互接口和人类独有的活性部位,因此最好的药物设计的目标。”
柯林斯评论发表药物发现领域的影响:“我们希望这种结构鼓励筛选小分子抑制剂的使用其披露关于亚基相互作用限制在细胞中端粒酶功能(例如直流疾病突变)。
”也,有均匀的端粒酶样品制备方法为基于活动的小分子筛选提供了机会。最重要的是我认为它消除瓶颈的影响我们希望可以抑制端粒酶,这是一个研究团体的灵感。”
伊娃诺加利斯博士和教授凯瑟琳·柯林斯说劳拉·伊丽莎白·梅森,科普作家技术网络。188金宝搏备用
引用
1。
阮,t·H。Tam, J。,Wu, R. A., Greber, B. J., Toso, D., Nogales, E., & Collins, K. (2018). Cryo-EM structure of substrate-bound human telomerase holoenzyme. Nature. doi:10.1038/s41586-018-0062-x
2。
琮、Y。,Wright, W. E., & Shay, J. W. (2002). Human Telomerase and Its Regulation. Microbiology and Molecular Biology Reviews, 66(3), 407-425. doi:10.1128/mmbr.66.3.407-425.2002
3所示。
2009年诺贝尔生理学或医学奖的新闻稿。(2009)。从https://www.nobelprize.org/nobel_prizes/medicine/laureates/2009/press.html获取。上次访问:2018年4月30日
4所示。
米切尔,j . R。、木、E。,& Collins, K. (1999). A telomerase component is defective in the human disease dyskeratosis congenita. Nature, 402(6761), 551-555. doi:10.1038/990141
广告


