翻译后修饰介绍

什么是翻译后修饰?
翻译通常被认为是生物学“中心法则”的“最后一步”DNA先转化为RNA,再转化为蛋白质.然而,在蛋白质合成之后,细胞、组织和生物体实现其功能生物学和多样性还需要其他步骤。翻译后修饰是对蛋白质的改变后合成,通常由酶介导的合成
为什么翻译后修饰如此重要?
2003年第一个人类基因组的测序是分子生物学的一个重要里程碑。从那以后的几年里,人类蛋白质组-蛋白质的集合变得越来越明显是或可以 在某一特定时间表达在人类身上-在分类上更为复杂。为什么?人类的蛋白质组极其多样。虽然人体不同细胞群的基因组本质上是恒定的(除了少数例外),但为了使单个细胞执行各自的功能,并对环境刺激做出反应,必须在细胞、组织和器官的不同时间点表达各种不同的蛋白质。据估计,有~20- 25000个蛋白质编码基因,而蛋白质组估计有超过1,000,000个蛋白质大小。蛋白质组的多样性是通过几种不同的机制实现的;转录后修饰就是一个例子。

翻译后修饰的例子:
在这里,我们总结了翻译后修饰的五个关键例子。这并不是一个详尽的列表,因为迄今为止已经确定了200多种不同类型的翻译后修饰。1蛋白质磷酸化
蛋白质磷酸化是翻译后修饰中最常见、研究最多的修饰之一。它需要特定氨基酸残基的磷酸化,通过激酶将磷酸基添加到极性基团R上,最常发生在丝氨酸、酪氨酸或苏氨酸残基上。磷酸基的加入导致蛋白质的修饰,由此它从疏水极性转变为亲水极性,使其能够与其他分子相互作用-本质上“激活”它。蛋白质磷酸化是一种可逆的翻译后修饰,对于细胞调节以及酶和受体的激活和失活非常重要,这可能与癌症等疾病过程有关。2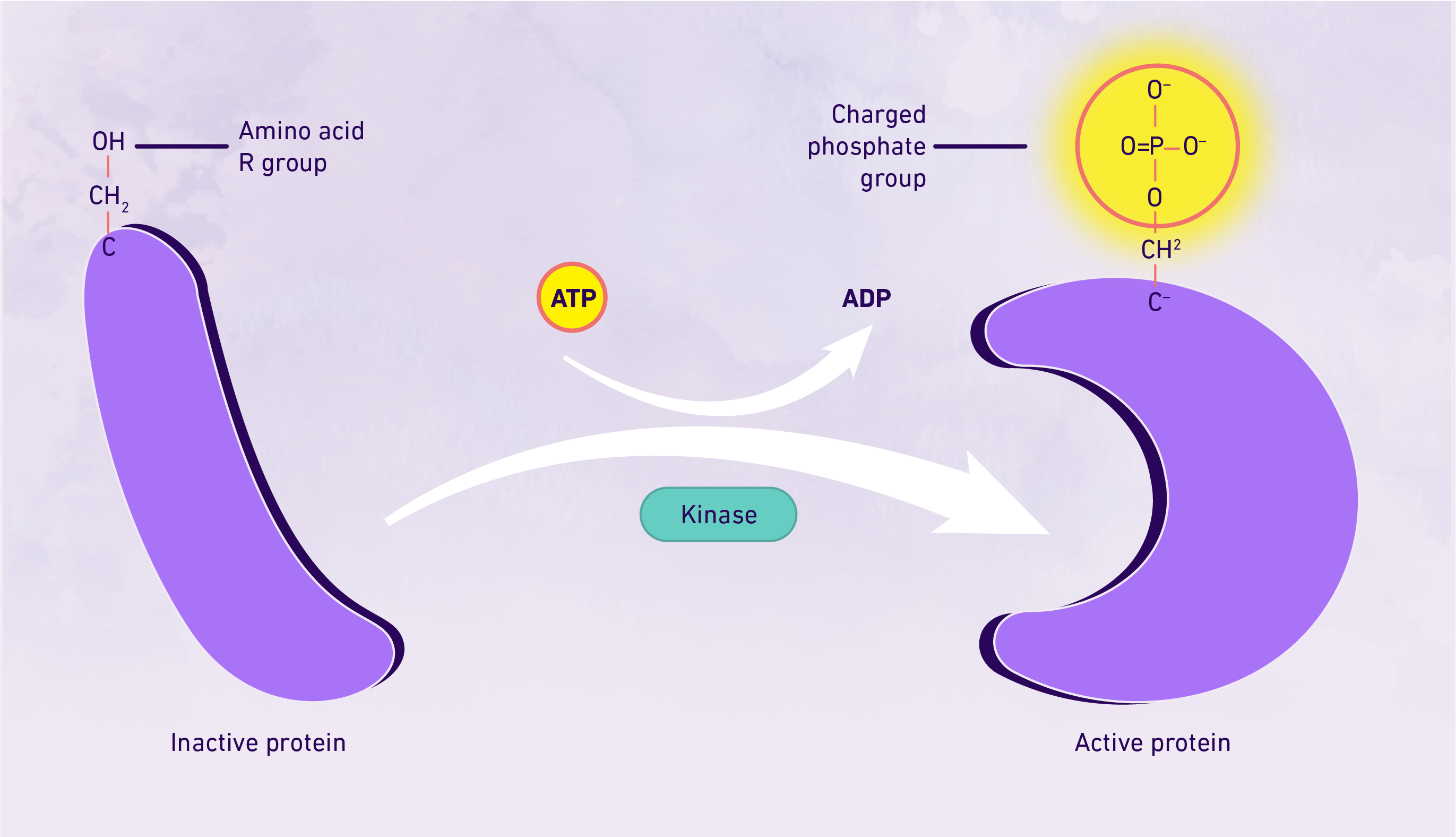
蛋白质糖基化
蛋白质糖基化被认为是最“复杂”但最常发生的翻译后修饰之一。3.它涉及到碳水化合物部分的共价添加到氨基酸,形成糖蛋白。糖基化反应是多种多样的,由各种不同的酶催化,这些酶将特定的聚糖连接到特定的氨基酸上。糖蛋白估计占蛋白质组的50%左右;然而,由于糖蛋白异构体的数量和多样性,糖蛋白组的研究具有挑战性。4真核生物蛋白质的糖基化通常分为两大类;n键,即一个糖分子连接到天冬酰胺的酰胺氮上;o键,即一个糖分子连接到丝氨酸或苏氨酸的氧原子上。
糖蛋白组研究有一系列的应用;许多糖蛋白具有结构功能,而免疫球蛋白是免疫的核心,表面呈现的糖蛋白和糖脂决定人的血型类型。3.由于质谱(MS)等分析技术的进步,我们对人类糖蛋白组和糖基化的意义的认识不断增长。
蛋白质泛素化
泛素是一种小蛋白质——大约8kDa大小——可以在一个被称为泛素化的过程中与底物蛋白结合,泛素化是一种翻译后修饰,用于调节蛋白质的功能或标记其降解。泛素化发生在三个连续的步骤,由三组酶催化。
这一过程通常以泛素和蛋白质底物赖氨酸残基之间的异肽键形成而告终。5 Monoubiquitination泛指添加一个泛素分子,而添加几个泛素蛋白称为polyubiquitination.
泛素化有多种功能,最常见的是标记蛋白质以供蛋白酶体降解,但也有其他功能,包括:免疫和炎症反应,细胞器生物发生和DNA修复中的信号作用。6
蛋白甲基化
蛋白质甲基化在许多重要的细胞过程中起着调节作用,包括基因转录和信号转导。7在蛋白质甲基化过程中,被称为甲基转移酶的酶向蛋白质分子上的特定氨基酸(如赖氨酸和精氨酸残基)添加甲基(最常见的是由s -腺苷-l-蛋氨酸或SAM提供)。蛋白质甲基化会对以下方面产生影响:- 蛋白质的稳定性
- 蛋白质亚细胞定位
- 原聚体结合亲和力
- 蛋白质相互作用
- 其他蛋白质修饰事件
因此,它经常在癌症的背景下进行研究,其中细胞过程和细胞周期的调节可能会出错。8个体蛋白质甲基化过程的表征是一个不断增长的研究领域,由于MS的进步,逐渐变得更容易研究;然而,甲基组的复杂性使得使用目前可用的工具将其作为一个集体进行分析具有挑战性。9
蛋白质乙酰化作用
蛋白质乙酰化是真核生物中常见的翻译后修饰,涉及通过可逆和不可逆过程将乙酰基添加到氮上。
乙酰化已经在组蛋白中进行了大量的研究,组蛋白是将DNA打包到染色体中的蛋白质,其中组蛋白n项上赖氨酸侧链(ε-NH2)的乙酰化与基因表达的调控有关。如果赖氨酸被乙酰化,它就不再带正电荷。反过来,DNA与组蛋白的结合被放松,从而促进基因的转录。虽然组蛋白研究在该领域占据主导地位,但科学家们现在怀疑,在不同的生物过程中,特别是在细菌中,存在着广泛的蛋白质乙酰化,这些蛋白质乙酰化可能具有重要的生理功能。10,11

翻译后修饰研究展望
翻译后修饰是蛋白质组多样性的关键,反过来,也是生物体多样性的关键。虽然基于ms的蛋白质组学促进了对翻译后修饰在生物过程中所起作用的新见解,但我们仍有一段路要走。在未来,表征和映射修改具有高灵敏度的蛋白质组而且在我们追求个性化医疗的过程中,特异性无疑将为诊断和药物开发等科学学科带来重大进展。12翻译后修饰汇总表
译后修改 |
机制 |
蛋白质磷酸化 |
磷酸基对氨基酸残基的添加。 |
蛋白质糖基化 |
糖蛋白:碳水化合物部分与氨基酸共价相加,形成糖蛋白 |
蛋白质泛素化 |
一个泛素蛋白与另一个蛋白质通过三步结合。 |
蛋白甲基化 |
甲基的添加,通常是在赖氨酸或精氨酸残基上。 |
蛋白质乙酰化作用 |
乙酰基加在蛋白质n端或赖氨酸残基上的乙酰基 |
引用:
1.
王志强,王志强,等。破译功能相关的翻译后修饰的全球网络。Mol系统生物学.2012; 8:599。doi:10.1038 / msb.2012.31.
2.
Ardito F, Giuliani M, Perrone D, Troiano G, Lo Muzio L.蛋白磷酸化在细胞信号传导中的关键作用及其在靶向治疗中的应用(综述)。国际Mol医学。40 2017;(2): 271 - 280。doi:10.3892 / ijmm.2017.3036.
3.
斯皮罗RG。蛋白质糖基化:糖肽键的性质、分布、酶的形成和疾病的意义。糖生物学.2002; 12 (4): 43 r-56r。doi:10.1093 / glycob / 12.4.43R.
4.
姬姬杰,郭文杰,郭文杰。O-GalNAc蛋白糖基化的研究进展。细胞生物学趋势.2011; 21(3): 149 - 158。doi:10.1016 / j.tcb.2010.11.004.
5.
科曼德D强奸m泛素密码。Annu Rev生物化学.2012, 81(1): 203 - 229。doi:10.1146 / annurev -生物化学- 060310 - 170328.
6.
孙林,陈志军。泛素化在信号传递中的新功能。Curr Opin细胞生物学.2004年,16(2):119 - 126。doi:10.1016 / j.ceb.2004.02.005.
7.
穆军,史勇。蛋白质甲基化研究的曲折路径:里程碑和新领域。《自然分子细胞生物学.2017; 18(8): 517 - 527。doi:10.1038 / nrm.2017.35.
8.
Hamamoto R, Nakamura Y.蛋白质甲基转移酶在人类癌症中的异常调节:抗癌治疗的一个新兴靶标类。癌症科学.2016, 107(4): 377 - 384。doi:10.1111 / cas.12884.
9.
第10章-甲基组分析的当前方法。见:郑毅刚主编,表观遗传技术应用。学术出版社;2015:187 - 217。doi:10.1016 / b978 - 0 - 12 - 801080 - 8.00010 - 7.
10.
夏超,陶勇,李敏,车涛,曲娟。蛋白质乙酰化和去乙酰化:基因转录中的重要调控修饰(综述)。Exp Ther Med.2020; 20(4): 2923 - 2940。doi:10.3892 / etm.2020.9073.
11. 谢晓霞,李志强,等。翻译后蛋白质乙酰化:细菌动态调节代谢功能的优雅机制。微生物学前沿.2019; 10:1604。doi:10.3389 / fmicb.2019.01604.




