蛋白质组学的发展——理查德Scheltema博士

阅读时间:
理查德Scheltema乌得勒支大学的助理教授,他领导了Scheltema实验室广泛的上下文内的群吗艾伯特见鬼。
研究小组专注于质谱(MS)结构蛋白质组学为基础,发展先进的液相色谱-光谱法(质/ MS)平台和分析软件与其他研究人员密切合作,如亚历山大·马卡洛夫后来功能蛋白质组学的发展。
Scheltema的核心开发人员XlinkX蛋白质组的发现者,和他的团队采用这项技术来获得深入定量对蛋白质,除了收集特殊信息回答有趣的生物学问题。
莫莉·坎贝尔(MC):最大的突破是蛋白质组学研究领域近年来吗?
理查德Scheltema (RS):女士在我的应用程序基于蛋白质组学多年来是非常令人兴奋的。乐器,基本上是只测量质量和粗糙的丰度能够:
- 提取蛋白质的存在
- 提取的转录后修饰蛋白质和化学计量学的存在
- 估计人类基因组
- 发现哪些蛋白质相互作用
- 推导结构信息
- 找出蛋白质的细胞定位
所以——这是令人兴奋的。
然而,尽管所有这些应用程序背后的思想,使他们工作在功能层面上非常聪明,他们都使用的质量好坏女士平台。有鉴于此,我认为唯一的答案真的可以持续发展的平台的速度和灵敏度女士在过去几十年。的进步我们看到平台使研究人员探索聪明的想法导致的最终应用程序的女士Orbitrap家族的质谱仪在女士展示了惊人的进步。
主持人:你的研究利用交联质谱(XL-MS)。你能告诉我们更多关于这种方法和原因,为你工作,它优于其他可用的技术?
拉尔夫-舒马赫:XL-MS我们感兴趣的是研究蛋白质结构和蛋白质的相互作用。这是实现“交联”阶段的增溶的蛋白质(复杂)在本土国家和孵化与交联试剂——小的化学物质有两个胺反应结束后,形成了两个氨基酸之间的共价键。交联后的阶段,蛋白质(复杂的)处理最后看到蛋白(s)切成肽蛋白酶(图1中,面板我)。

主持人:你的研究利用交联质谱(XL-MS)。你能告诉我们更多关于这种方法和原因,为你工作,它优于其他可用的技术?
拉尔夫-舒马赫:XL-MS我们感兴趣的是研究蛋白质结构和蛋白质的相互作用。这是实现“交联”阶段的增溶的蛋白质(复杂)在本土国家和孵化与交联试剂——小的化学物质有两个胺反应结束后,形成了两个氨基酸之间的共价键。交联后的阶段,蛋白质(复杂的)处理最后看到蛋白(s)切成肽蛋白酶(图1中,面板我)。

图1:一般XL-MS工作流。原始图。信贷:理查德Scheltema。
这导致一个示例包含正常肽和交联试剂2肽连接的副本。这个混合物是女士随后测量的识别,在大多数情况下,氨基酸参与交联可以分配给我们提供一个距离约束定义为间隔臂的长度和两个侧链。这些距离约束提供了有价值的信息关于蛋白质折叠(两个肽来自相同的蛋白质)或蛋白质交互和界面的交互所在地(两个肽来自不同的蛋白质)。
这导致一个示例包含正常肽和交联试剂2肽连接的副本。这个混合物是女士随后测量的识别,在大多数情况下,氨基酸参与交联可以分配给我们提供一个距离约束定义为间隔臂的长度和两个侧链。这些距离约束提供了有价值的信息关于蛋白质折叠(两个肽来自相同的蛋白质)或蛋白质交互和界面的交互所在地(两个肽来自不同的蛋白质)。

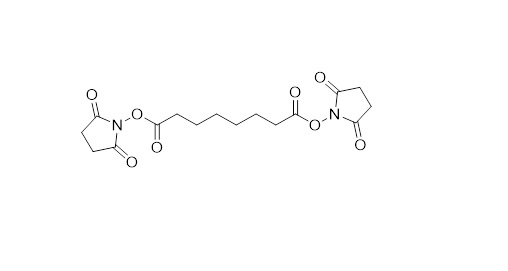
图2:DSS交联试剂。
原始图。信贷:理查德Scheltema。
反应结束由一个间隔臂,通常的sidechains氨基酸是有针对性的,导致结构分辨率15至50(图2)。这绝不是附近的决议,可以实现与晶体学等技术,电子显微镜(EM),或核磁阻(NMR)谱。因此,我们不打算与这些技术为解决结构信息——我认为我们所做的是高度互补。我们例如不仅仅局限在大小的蛋白质和蛋白复合物在接受调查,峰值在蛋白质结构,并不为蛋白质结构的灵活性,可以处理高度复杂的混合物。虽然相对较低分辨率的信息是,当结合高分辨率的晶体结构的各个子单元和/或高分辨率EM地图,可以建立一幅非常详细的结构。

图3:XL-MS结合Cryo-TEM。原始图。信贷:理查德Scheltema。
我们解决复杂的溶解产物的能力将很可能导致XL-MS获得很多牵引在可预见的未来。
透射电子cryomicroscopy (Cryo-TEM),整个细胞由电磁成像,在哪里看到一个伟大的使用激增。从蛋白质结构轮廓记录这种技术,很难确定哪些蛋白参与彼此,他们是如何安排完整的结构内,我们提供答案的问题。
记住这一点,我们申请了格兰特在荷兰科学理事会的目标发展的方法结婚与XL-MS Cryo-TEM。我们希望实现这一目标通过使用自动化的蛋白质对接的解决方案,我们希望注入很多女士测量得到的知识。我们非常相信我们能够成功,我们的目标是调查生物拥有大量潜力发现新的蛋白复合物。这个项目是一个优秀的团队领导的主要调查人员等John van der东,艾伯特见鬼,亚历山大Bonvin,弗里德里希·福斯特把,和我自己。
我们解决这个问题,我们认为这是现在解决——就是从富集磷酸化肽的发展与固定化金属亲和色谱法(IMAC)技术。IMAC的优势在于,它已经大规模自动化、phospho-groups很容易脱离珠子,它有奇妙的特异性(即non-phosphorylated肽可以几乎完全分离磷酸化的),重要的是phospho-group很小相比,生物素。为此,我们开发了一个tri-functional交联试剂,PhoX,包含一个磷富集处理。从我们的实验中我们发现,有了这个试剂,我们的确在创建纯样品中获得难以置信的性能,从而使交联肽的检测非常容易。
第二个主要关心这些实验是我们能够产生大量的结构数据,目前还没有相关的蛋白质数据银行结构。特别是从复杂的溶解产物我们观察许多复合物的各个子单元从未与EM(成功)结晶或记录。这实质上阻止我们建立一个结构的交联复合物基于单个亚基之间的复杂。处理这种情况我们和其他人恢复结构造型使用检测intra-links为每个单独的子单元。发达的工具真的很神奇,因为他们可以提供一个结构对于一个给定的氨基酸序列,在很多情况下,非常合理。问题是,我们倾向于寻找最好的结构生成的许多可能性。为此,发现交联非常有助于验证和过滤,但大量的手工工作也需要提取生物最相关的模型从所有的可能性。这将导致非常长期的正规项目试图揭示结构细节。为此,到目前为止没有提出简单的修复和搜寻仍在继续。
反应结束由一个间隔臂,通常的sidechains氨基酸是有针对性的,导致结构分辨率15至50(图2)。这绝不是附近的决议,可以实现与晶体学等技术,电子显微镜(EM),或核磁阻(NMR)谱。因此,我们不打算与这些技术为解决结构信息——我认为我们所做的是高度互补。我们例如不仅仅局限在大小的蛋白质和蛋白复合物在接受调查,峰值在蛋白质结构,并不为蛋白质结构的灵活性,可以处理高度复杂的混合物。虽然相对较低分辨率的信息是,当结合高分辨率的晶体结构的各个子单元和/或高分辨率EM地图,可以建立一幅非常详细的结构。

图3:XL-MS结合Cryo-TEM。原始图。信贷:理查德Scheltema。
我们解决复杂的溶解产物的能力将很可能导致XL-MS获得很多牵引在可预见的未来。
透射电子cryomicroscopy (Cryo-TEM),整个细胞由电磁成像,在哪里看到一个伟大的使用激增。从蛋白质结构轮廓记录这种技术,很难确定哪些蛋白参与彼此,他们是如何安排完整的结构内,我们提供答案的问题。
记住这一点,我们申请了格兰特在荷兰科学理事会的目标发展的方法结婚与XL-MS Cryo-TEM。我们希望实现这一目标通过使用自动化的蛋白质对接的解决方案,我们希望注入很多女士测量得到的知识。我们非常相信我们能够成功,我们的目标是调查生物拥有大量潜力发现新的蛋白复合物。这个项目是一个优秀的团队领导的主要调查人员等John van der东,艾伯特见鬼,亚历山大Bonvin,弗里德里希·福斯特把,和我自己。
MC:一个关键特性是具有吸引力的蛋白质组学数据处理软件?参与小说的发展过程是什么软件?
拉尔夫-舒马赫:蛋白质组学数据处理软件是我小说的一个实验室在更大的背景下的集团。样品记录在XL-MS研究额外的复杂性,我们仍然记录数据和两个连接肽(与正常蛋白质组学实验,测量一个肽)。当我们开始发展软件,已经有解决方案了;然而,我们想要进入这一领域,使实验与高度复杂的溶解产物覆盖的面积,然后没有现有的解决方案。此外,我们发现改变数据分析软件的能力也非常有利于它提供的灵活性来执行“开箱即用”的实验。在开发期间,除了确保提取肽识别的正确性,我们强调用户友好。我们定义这是(1)在任何桌面pc上运行能力(需要大量的优化算法),(2)简单的结果,要求图形可视化和可浏览表和(3)支持的问题和/或问题。
拉尔夫-舒马赫:蛋白质组学数据处理软件是我小说的一个实验室在更大的背景下的集团。样品记录在XL-MS研究额外的复杂性,我们仍然记录数据和两个连接肽(与正常蛋白质组学实验,测量一个肽)。当我们开始发展软件,已经有解决方案了;然而,我们想要进入这一领域,使实验与高度复杂的溶解产物覆盖的面积,然后没有现有的解决方案。此外,我们发现改变数据分析软件的能力也非常有利于它提供的灵活性来执行“开箱即用”的实验。在开发期间,除了确保提取肽识别的正确性,我们强调用户友好。我们定义这是(1)在任何桌面pc上运行能力(需要大量的优化算法),(2)简单的结果,要求图形可视化和可浏览表和(3)支持的问题和/或问题。
我们实现这些目标的整合开发数据分析的部分已经建立环境蛋白质组发现者。在这里,我们有友好的表表示的优势和可视化工具,现有的支持结构,很多人已经习惯于如何使用蛋白质组发现,和帮助台可用的问题。
额外的关心我们的是大量的生物信息学解决方案似乎被干掉,这意味着一旦他们发表的支持和推动继续发展。最终,这意味着软件变得无法使用。我们非常渴望与我们的软件解决方案,防止这种设想它是利用全球——这是如此。
主持人:在2018年发表的一项研究,你的团队研究了组蛋白蛋白质交互景观使用XL-MS完整细胞核。你能告诉我们关于你的发现和贡献什么?进一步研究如何扩大数据?
拉尔夫-舒马赫:交联提供的完整的核组蛋白相互作用网络和设置的快照的基础调查刺激如何影响染色质/调节组蛋白interactome组织和影响力。然而,进一步的实验,重要的是,增加深度的分析我们实现——是必要的。我们想申请核XL-MS工作流在细胞治疗组蛋白脱乙酰酶抑制剂(HDAC抑制剂),促进染色质的解包。这种放松的染色质状态促进转录和将使我们能够研究内生的动力和组织转录复合体。
我们已经在一定程度上揭示了压抑和激活组蛋白标记(甲基化和乙酰化组蛋白尾巴)驱动器其他蛋白质的相互作用。此外,我们发现已知的扶少团团员组织蛋白的交互接口,我们可以在现有的模型组蛋白的结构。
主持人:你面临的一些关键挑战是什么结构蛋白质组学吗?
拉尔夫-舒马赫:有两个重大关切XL-MS实验。第一个与低丰度的交联肽产品。从现有的数据,我们估计,超过99%的材料注入到质谱仪包括正常肽(肽不修改的交联试剂),携带没有结构信息。
主持人:在2018年发表的一项研究,你的团队研究了组蛋白蛋白质交互景观使用XL-MS完整细胞核。你能告诉我们关于你的发现和贡献什么?进一步研究如何扩大数据?
拉尔夫-舒马赫:交联提供的完整的核组蛋白相互作用网络和设置的快照的基础调查刺激如何影响染色质/调节组蛋白interactome组织和影响力。然而,进一步的实验,重要的是,增加深度的分析我们实现——是必要的。我们想申请核XL-MS工作流在细胞治疗组蛋白脱乙酰酶抑制剂(HDAC抑制剂),促进染色质的解包。这种放松的染色质状态促进转录和将使我们能够研究内生的动力和组织转录复合体。
我们已经在一定程度上揭示了压抑和激活组蛋白标记(甲基化和乙酰化组蛋白尾巴)驱动器其他蛋白质的相互作用。此外,我们发现已知的扶少团团员组织蛋白的交互接口,我们可以在现有的模型组蛋白的结构。
主持人:你面临的一些关键挑战是什么结构蛋白质组学吗?
拉尔夫-舒马赫:有两个重大关切XL-MS实验。第一个与低丰度的交联肽产品。从现有的数据,我们估计,超过99%的材料注入到质谱仪包括正常肽(肽不修改的交联试剂),携带没有结构信息。
这使得很难检测交联肽,我们之后的结构信息。多年来研究者们被迫采取两种方法,要么严重pre-fractionated基于样本大小(两种交联肽比正常肽)或电荷(两个胰蛋白酶的肽的两倍收取一个正常肽)的潜力。这是一个昂贵的业务,对于大型项目我们必须运行20 x 3人力资源测量所有的分数来衡量。因为我们也想做复制,这再次繁殖是由三个因素造成的如果我们看着一个系统,如果我们更高的因素包括经济刺激的系统变化。
研究人员一直在采取的另一种方法是将一个浓缩处理直接在交联试剂——创建一个所谓的tri-functional交联试剂。此前,生物素被用作处理。然而从来没有发现生产试剂牵引,因为它仍然难以有效地分离生物素的珠子用于捕获。生物素处理另外使试剂非常笨重的可能导致空间位阻和低进入蛋白质结构进行调查。
研究人员一直在采取的另一种方法是将一个浓缩处理直接在交联试剂——创建一个所谓的tri-functional交联试剂。此前,生物素被用作处理。然而从来没有发现生产试剂牵引,因为它仍然难以有效地分离生物素的珠子用于捕获。生物素处理另外使试剂非常笨重的可能导致空间位阻和低进入蛋白质结构进行调查。
我们解决这个问题,我们认为这是现在解决——就是从富集磷酸化肽的发展与固定化金属亲和色谱法(IMAC)技术。IMAC的优势在于,它已经大规模自动化、phospho-groups很容易脱离珠子,它有奇妙的特异性(即non-phosphorylated肽可以几乎完全分离磷酸化的),重要的是phospho-group很小相比,生物素。为此,我们开发了一个tri-functional交联试剂,PhoX,包含一个磷富集处理。从我们的实验中我们发现,有了这个试剂,我们的确在创建纯样品中获得难以置信的性能,从而使交联肽的检测非常容易。
第二个主要关心这些实验是我们能够产生大量的结构数据,目前还没有相关的蛋白质数据银行结构。特别是从复杂的溶解产物我们观察许多复合物的各个子单元从未与EM(成功)结晶或记录。这实质上阻止我们建立一个结构的交联复合物基于单个亚基之间的复杂。处理这种情况我们和其他人恢复结构造型使用检测intra-links为每个单独的子单元。发达的工具真的很神奇,因为他们可以提供一个结构对于一个给定的氨基酸序列,在很多情况下,非常合理。问题是,我们倾向于寻找最好的结构生成的许多可能性。为此,发现交联非常有助于验证和过滤,但大量的手工工作也需要提取生物最相关的模型从所有的可能性。这将导致非常长期的正规项目试图揭示结构细节。为此,到目前为止没有提出简单的修复和搜寻仍在继续。
主持人:蛋白质组学研究领域也在不断地演变和变化。关键突破你想看什么发生在未来几年?
拉尔夫-舒马赫:明显的进步当然会进一步改善我们女士平台利用,而且我们使用的液相色谱平台分离肽混合物通过一个测量会非常感谢——无论是在性能和稳定性方面,特别是稳定仍是有些担心。小说分裂技术的发展和改进现有方法会非常高兴看到。
最后,我将会非常兴奋地看到进展蛋白质纯化、样品制备、数据分析软件——基本上就是蛋白质组学的方方面面。生成的所有信息是有用的对我们的结构研究,所以,一切都是受欢迎的!
拉尔夫-舒马赫:明显的进步当然会进一步改善我们女士平台利用,而且我们使用的液相色谱平台分离肽混合物通过一个测量会非常感谢——无论是在性能和稳定性方面,特别是稳定仍是有些担心。小说分裂技术的发展和改进现有方法会非常高兴看到。
最后,我将会非常兴奋地看到进展蛋白质纯化、样品制备、数据分析软件——基本上就是蛋白质组学的方方面面。生成的所有信息是有用的对我们的结构研究,所以,一切都是受欢迎的!
理查德Scheltema与莫莉坎贝尔说,科普作家、技术网络。188金宝搏备用
广告



