利用蛋白质降解来瞄准难以下药的食物

阅读时间:
蛋白质的生命
蛋白质是在翻译过程中基于mRNA模板合成的,翻译过程发生在核糖体(图1)中。核糖体是一种核糖核蛋白复合物,存在于细胞质中或与内质网(ER)相关。翻译后,新产生的蛋白质通常在伴侣的帮助下折叠成它们的原生结构,并被运输到它们的目标细胞室。
蛋白质的半衰期各不相同,从几分钟到甚至几年不等,就像细胞外基质的某些成分一样。当蛋白质降解时,它们主要通过两种途径被分解:
- 分泌蛋白和质膜蛋白被内吞并转运到溶酶体,在那里它们通过溶酶体蛋白酶降解。这些蛋白酶也在微观和宏观自噬过程中发挥蛋白降解作用。
- 蛋白质降解的另一种途径是泛素介导的蛋白酶体依赖性降解。
在这篇文章中,我们将讨论泛素介导的蛋白酶体依赖性降解的机制,并讨论它如何被用于设计新的治疗方法,可以将任何类型的人类蛋白质转化为治疗靶点。
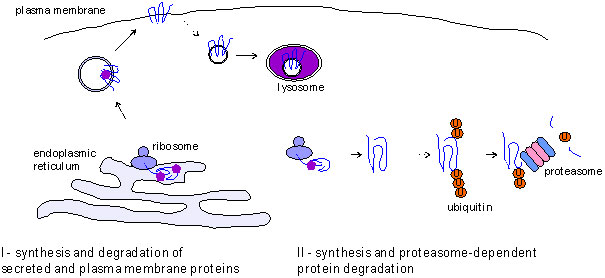
图1。蛋白质的生命周期(来源:Proteintech)左图:分泌和质膜蛋白在与内质网相关的核糖体上合成,并主要通过内吞途径在溶酶体中降解。右图:细胞内蛋白质在细胞质中的核糖体上合成,并在蛋白酶体中由泛素介导降解。
泛素和蛋白酶体依赖性降解
泛素是一种约9kDa的小蛋白质,几乎存在于每个人体细胞中,通常以多聚体形式存在或与其他蛋白质连接。蛋白质与泛素的偶联是泛素介导的蛋白酶体依赖性降解的基础。这是一个高度调控的机制,涉及三种类型的酶(图2)。
该反应的引发剂是泛素激活酶E1,它产生活性的泛素硫酯形式。E2泛素偶联酶与激活的泛素结合,而E3连接酶招募细胞蛋白进行降解,并介导泛素转移到目标蛋白的赖氨酸残基。在大多数情况下,这一过程是循环的,导致泛素链的延伸,因为泛素分子也具有赖氨酸基团。多泛素化的蛋白质然后被26S蛋白酶体识别,26S蛋白酶体是由20S核心和19S调节颗粒组成的多聚体复合体,存在于一端或两端。19S颗粒识别多泛素化蛋白作为底物,而20S核心则进行蛋白降解。
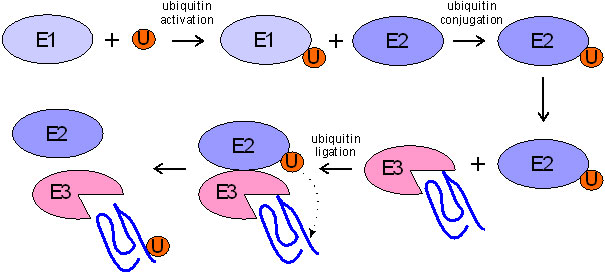
图2。蛋白质泛素化(来源:Proteintech) 泛素激活酶E1、偶联酶E2和泛素连接酶E3的级联负责将泛素分子转移到靶蛋白上。
PROTACs- - - - - -使用e3连接酶介导的蛋白质降解的药物
蛋白水解靶向嵌合体(Proteolysis targeting chimeras, PROTACs)是一种新的治疗方法,它采用靶向蛋白质降解作为一种作用模式。它们由两个结构域组成——靶蛋白的结合结构域和E3连接酶募集的配体(图3)。PROTACs与靶蛋白和E3-泛素连接酶复合物的结合使降解机制靠近靶蛋白,导致其随后的多泛素化。泛素化的目标蛋白然后被26S蛋白酶体结构域识别并被蛋白水解消化。在整个过程中,protac作为催化剂,不被降解;因此,它们特别有效,因为它们仍然能够催化目标蛋白的许多分子随后的泛素化。
第一代protac使用来自E3连接酶天然配体的肽进行招募6、7 ,它提供了所需的活性,但通常不具有细胞渗透性,或者需要微摩尔浓度才能有效地降解目标。转向使用工程小分子E3连接酶配体降低了它们的分子量,提高了细胞的渗透性和效力 .1、2

图3。PROTACs的作用机制(来源:Proteintech) PROTACs介导靶蛋白和E2-E3复合物之间的相互作用,允许泛素转移到靶蛋白上。PROTACs蛋白靶点包括核受体(如AR)、转录因子(如ARNT)、激酶(如HER2)和支架蛋白(如BRD9)。用22576-1-AP对10%甲醛固定HepG2细胞进行免疫荧光分析(雄性激素受体抗体)稀释1:50。WB结果ARNT (HIF1B)据美联社;抗体(14105 - 1 -1:3000;在室温下孵育1.5小时)与sh-Control和sh-ARNT (HIF1B)转染的HeLa细胞。18299 - 1 - ap (HER2 / ErbB2用Tris-EDTA缓冲液(pH9)提取热介导抗原,稀释1:60(40倍镜下)。对HeLa细胞进行SDS PAGE和24785-1-AP western blot (BRD9抗体)以1:1000稀释,室温孵育1.5小时。
protac相对于其他模式的优势
一般来说,两种最常见的治疗类型是小分子和单克隆抗体(mAbs)。小分子是非常多功能的,可以作用于细胞外和细胞内的目标,不像单克隆抗体主要作用于细胞外蛋白质,如细胞受体(表1)。小分子和单克隆抗体都主要通过与目标分子结合来影响给定的结果——例如,阻止其活性,抑制与其他伙伴的结合或激活某种途径。单克隆抗体通常具有低毒性的高特异性,这通常是小分子候选药物难以实现的。另一方面,小分子由于分子量低,通常具有更好的组织穿透力,具有较短的半衰期和较短的药效。新的模式,如抗体药物偶联物(adc)或fc融合蛋白试图克服这些挑战。然而,它们并没有克服主要的障碍:它们并没有大大扩展这些模式下可药物化的蛋白质类别。
PROTACs的作用机制是基于与靶蛋白的选择性结合来触发其催化降解。与其他模式不同,结合位点不必局限于某些蛋白质结构域,例如酶的活性位点以与其底物竞争或蛋白质相互作用位点以阻止结合。
从理论上讲,蛋白质表面的任何位点都可以被PROTACs靶向,只要它为给定的分子提供特异性。这也为选择性靶向突变蛋白质或蛋白质异构体提供了比小分子更大的优势。一个有趣的概念是使用仅在某些细胞状态下有功能的靶蛋白结合域,例如磷酸protac仅在磷酸化状态下有活性 .3.由于PROTAC的作用机制涉及到目标蛋白的催化降解,因此PROTACs可以靶向支架蛋白、非酶蛋白-蛋白相互作用靶点或有毒蛋白聚集物。即使是低剂量的药物也足以发挥作用。
表1。小分子、抗体和PROTACs的药物性质比较。
| 功能 | 小分子 | 抗体 | PROTACs |
| 细胞外的目标 | 是的 | 是的 | 没有 |
| 细胞内目标 | 是的 | 没有 | 是的 |
| 脚手架蛋白靶点 | 有限的 | 没有 | 是的 |
| 蛋白质-蛋白质相互作用的靶标 | 有限的 | 有限的 | 是的 |
| 靶向突变蛋白/蛋白异构体 | 有限的 | 有限的 | 是的 |
| 作用机制 | 结合以触发目标的抑制/激活 | 结合以触发目标的抑制/激活 |
结合和催化降解目标 |
| 大小 | 小(1kda以下) | 大(约150 kDa) | 小-中型(小分子PROTACs可达1.5 kDa) |
| 半衰期 | 通常时间 | 几天到几周 | TBD |
| 药效学 | 短的表演 | 长期代理 | TBD |
| 剂量 | 每天 | 断断续续的 | TBD* |
| 选择性 | 有限的 | 高 | 高 |
| 组织渗透 | 好 | 有限的 | 好 |
*与小分子相比,预测的剂量更低
protac的未来
protac无疑有潜力在未来几年改变药物发现的格局。原理验证研究已经在基于细胞的实验中证明了它们对各种蛋白质靶标的降解活性,包括核受体、转录因子、激酶和支架蛋白(图3)。第一批PROTAC分子目前已进入临床开发阶段。目前的工作重点是发现和改进现有的E3连接酶连接剂,以及更好地了解目标蛋白之间的三级复合物,以破译是什么驱动了目标降解。例如,最近的研究表明,设计用于靶向许多蛋白质中存在的基序的protac可以成功地与绝大多数蛋白质结合,但只触发其中一小部分的降解 .4目前还没有在网上正确预测成功的模型。其他研究则通过改变配体和重新设计连接体来提高PROTACs的细胞渗透性。一种有趣的方法是将两种PROTAC前体通过咔嚓化学(称为cliptac)在细胞内组装成功能PROTAC分子 ).5
参考文献
- Bondeson, D. P., Mares, A., Smith, I. E., Ko, E., Campos, S., Miah, A. H., Mulholland, K. E., Routly, N., Buckley, D. L., Gustafson, J. L., Zinn, N., Grandi, P., Shimamura, S., Bergamini, G., Faelth-Savitski, M., Bantscheff, M., Cox, C., Gordon, D. A., Willard, R. R.,…Crews, C.(2015)。小分子PROTACs催化体内蛋白敲除。自然化学生物学,11(8), 611 - 617。https://doi.org/10.1038/nchembio.1858
- 巴克利,D. L.,瑞娜,K.,达里卡雷,N.,海恩斯,J.,古斯塔夫森,J. L.,史密斯,I. E.,米亚,A. H.,哈林,J. D.和克鲁斯,C. M.(2015)。HaloPROTACS:使用小分子PROTACs诱导HaloTag融合蛋白的降解。ACS化学生物学,10(8), 1831 - 1837。https://doi.org/10.1021/acschembio.5b00442
- 海恩斯,J.,高夫,J. D.,科森,T. W. &克鲁斯,C. M.(2013)。翻译后蛋白敲除偶联到受体酪氨酸激酶激活与磷protacs。美国国家科学院院刊,110(22), 8942 - 8947。https://doi.org/10.1073/pnas.1217206110
- 黄海涛,多布罗沃斯基,鲍克,杨国强,韦斯伯格,e.l.,博士,宗明,巴克利,d.l.,赵俊华。,Ko, E., Jang, J., Shi, K., Choi, H. G., Griffin, J. D., Li, Y., Treon, S. P., Fischer, E. S., Bradner, J. E., Tan, L., & Gray, N. S. (2018). A Chemoproteomic Approach to Query the Degradable Kinome Using a Multi-kinase Degrader.细胞化学生物学,25(1), 88 - 99. - e6。https://doi.org/10.1016/j.chembiol.2017.10.005
- Lebraud, H., Wright, d.j., Johnson, c.n., & Heightman, t.d.(2016)。蛋白水解靶向嵌合体的细胞内自组装蛋白降解。ACS中央科学,2(12), 927 - 934。https://doi.org/10.1021/acscentsci.6b00280
- Sakamoto, k.m., Kim, k.b., Kumagai, A, Mercurio, F., Crews, c.m., & Deshaies, r.j.(2001)。Protacs:靶向蛋白质到Skp1-Cullin-F盒复合体进行泛素化和降解的嵌合分子。美国国家科学院院刊,98(15), 8554 - 8559。https://doi.org/10.1073/pnas.141230798
- John S. Schneekloth, Fonseca, f.n ., Koldobskiy, M., Mandal, A., Deshaies, R., Sakamoto, K., & Crews, c.m .(2004)。蛋白质水平的化学遗传控制:体内选择性靶向降解。美国化学学会杂志,126(12), 3748 - 3754。https://doi.org/10.1021/ja039025z
广告


