为什么我蛋白的分子量不同于理论上预期的重量?

西方墨点法和分子量计算
西方墨点法(或免疫印迹)是一种常用的分子生物学技术分析蛋白质。预测蛋白质分子量(MW)是所有蛋白质氨基酸多工作站系统的总和。它可以计算使用,例如,在网上ExPASy工具。然而,这种计算MW可能不同于观察免疫印迹。下图总结了最常见的原因,为什么这可能发生(图1)。

图1所示。最常见的观察和理论之间的差异的原因多工作站系统。来源:Proteintech。
1。 信号肽(pro-peptide)被裂解
许多蛋白质运输通过分泌通路信号肽的氨基酸15 35长,主要位于N-termini。他们通常是由各种蛋白酶裂解在亚细胞的运输,导致成熟的蛋白质比预计的运行在一个较低的兆瓦。信号肽的存在可以使用各种在线工具或预测可以建立基于先前公布的数据。他们通常是注释在蛋白质数据库中,例如,UniProt。此外,蛋白质的一个子集pro-peptides——存在于蛋白质前体蛋白质域。蛋白质前体需要由蛋白酶处理以产生一种功能性产品,没有pro-peptide(图2)。

endoproteases还存在,一个家庭,是至关重要的球员在细胞监管网络控制炎症和细胞死亡。半胱天冬酶3 (19677 - 1 - ap)作为活性的酶原形式存在的32 kDa(第9),在凋亡信号,裂解成两个活动单元(p19/17和p12),组装成一个功能四聚物的酶(PMID: 7596430)。
基质金属蛋白酶(MMP)家族的蛋白参与细胞外基质的分解在许多生理过程,包括胚胎发育、繁殖、组织重构,和疾病过程,如关节炎或转移。大多数基质金属蛋白酶分泌活性pro-proteins,由细胞外蛋白酶裂解时被激活。不活跃的pro-MMP9 (10375 - 2 - ap)是92 kDa。顺序是裂解MMP3到加工形式通过一个中间68 kDa的形式- 78/82 kDa (PMID: 1371271)。MMP9也可以作为一个二聚体存在180 kDa (PMID: 7492685)。来源:Proteintech。
2。转录后修饰(铝)
天车共价修饰的蛋白质合成后发生。许多修改被酶催化,驻留在分泌通路,即内质网和高尔基体。天车蛋白质-蛋白质之间的关系有重要的调控作用,蛋白质稳定性、功能、酶活性和本地化。最常见的修改是磷酸化,主要发生在丝氨酸、酪氨酸和苏氨酸残基。磷酸化,像许多其他多功能天车,往往是瞬态-激酶催化磷酰基的附件组,而磷酸酶删除它们。大多数蛋白质进行氨基乙酰化作用,酶催化反应的氨基端乙酰转移酶(NATs)。一些氨基酸残基可以与低聚糖的过程称为N -和O-linked糖基化。泛素化,泛素,是一种常见的蛋白酶体降解的初始步骤。你可以找到更多关于多功能天车在这里。
糖基化和glycanation
大多数核糖体上合成的蛋白质与内质网进行糖基化。这意味着共价连接的糖添加到半个多肽链。
磷酸化
最常见的一种多功能天车是蛋白质磷酸化,发生在丝氨酸,苏氨酸和酪氨酸残基。蛋白质磷酸化调节功能,其酶活性、蛋白质相互作用和蛋白质定位。
添加单个磷酰基组添加+ / - 1 MW kDa,通常超出了标准的sds - page的决议。然而,多个磷酸化站点可以导致更加突出MW变化。
泛素化
蛋白质泛素化意味着共价泛素添加赖氨酸,半胱氨酸,丝氨酸,苏氨酸,或者直接到蛋白n端。通过蛋白质组学可以标记蛋白质泛素化降解。
3所示。蛋白复合物
大多数的蛋白质复合体由相关的蛋白质的共价债券。这些交互是摧毁在样品制备和电泳,和个人的蛋白质作为单体运行。这是由于这样的事实,sds - page对西方墨点法在减少条件执行。尽管如此,一些蛋白质复合物并没有完全中断,和蛋白质仍然可以存在于人类——或者heteromeric复合物的形式,甚至在减少代理人的存在,asSDS和β-Mercaptoethanol等。观察到兆瓦的复合物随后高于单体的计算兆瓦。也是常见的观察多个乐队代表单体的和复杂的物种(图3)。
注意:20%β-Mercaptoethanol(或100毫米德勤)4 x SDS样品缓冲可能有助于消除由于分离蛋白质复杂的非特定的乐队。

图3:NQO1 (11451 - 1 - ap)是一种酶,这种酶作为醌还原酶共轭反应的对苯二酚一起参与解毒途径以及生物合成的过程,如维生素K-dependent gamma-carboxylation谷氨酸残基的凝血酶原的合成。NQO1有三个亚型:26日,27日和31日kDa兆瓦,为的形成(66 - 70 kDa)需要的酶活性。
Mlx-interacting蛋白质(MLXIP,也称为MONDOA) (13614 - 1 - ap)作为转录因子与MLX形成异质二聚体蛋白质。这个复杂的绑定并激活转录从CACGTG E箱、发挥作用的转录激活糖酵解和glucose-responsive基因调控目标。MLXIP有三个亚型:110、57、69 kDa的MW MLXIP-MLX异质二聚体是130 kDa。来源:Proteintech。
4所示。蛋白亚型
在真核生物中,新微分mRNA转录pre-mRNAs经历成熟的步骤,导致mRNA的物种的数量和长度不同外显子,编码蛋白质的序列。蛋白质变异的基因被认为是蛋白亚型。蛋白亚型可以不同组织表达模式和独特的生理作用。因为不同的外显子的内容,蛋白亚型可以不同兆瓦(图4)。此外,信使rna可以承担多个翻译开始网站(TSS)标记蛋白质的n端的开始。使用多个tss创建蛋白亚型不同的n端,因此不同的兆瓦。
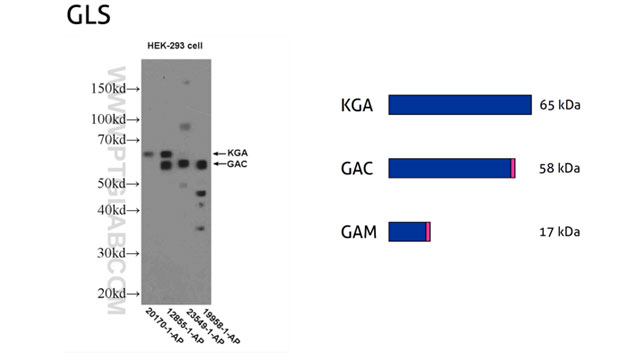
5。技术障碍
一个抗体大。
它是相对常见的观察额外活性物种在免疫印迹,不对应于任何形式的目标蛋白质。相反,他们代表无关的流感被抗体的蛋白质。抗体大通常需要仔细验证适当的控制,可以通过优化实验条件最小化。
提取缓冲至关重要的选择降低抗体的影响大。如果cytoplasmatic分析蛋白质,轻微提取缓冲不提取核蛋白质(例如,使用皂苷作为洗涤剂)可能更适合较低的非特异性大核蛋白质。转移后的蛋白质聚丙烯酰胺凝胶膜,阻止缓冲区的类型,孵化的时候与中小学抗体膜,和洗涤步骤都需要优化。建议比较不同抗体类型提出了对靶蛋白。如果检测到大与多克隆抗体,它可能不是与单克隆抗体,提出针对特定的抗原决定基而不是整个蛋白质序列或一个更大的蛋白质片段。
b。非特定的蛋白水解乳沟和蛋白质降解
蛋白质可以非特异性蛋白水解解理和退化。细胞和组织的分解释放额外的——以及胞内蛋白酶可以分裂蛋白多肽。因此,它是至关重要的补充裂解缓冲块蛋白酶的活性的蛋白酶抑制剂。一个建议是在冰上进行细胞溶菌作用进一步防止蛋白降解。蛋白水解的乳沟和降解都可以影响蛋白质不同程度较低,导致蛋白质片段兆瓦。
观察到兆瓦 |
潜在原因 |
| 高于预期 |
1。天车(见2)。 2。抗体检测蛋白同种型和一个长序列(见点(4)。 3所示。蛋白复合物(见第3点)。 |
| 低于预期 |
1。劈理的信号肽(见第一点)。 2。抗体检测蛋白同种型和一个短序列(见点(4)。 3所示。非特定的蛋白质劈理(见点5 b)。 |
| 不止一个乐队 |
1。蛋白亚型(见点(4)。 2。一种蛋白质产品,但不同的转译后的修改(见2)。 3所示。抗体检测蛋白有或没有pro-peptide(见第一点)。 4所示。蛋白复合物(见第3点)。 5。抗体大(见5点),可能由于免疫原序列的同源性。 |
| 没有乐队观察 |
1。蛋白质劈理(见点5 b)。 2。蛋白质降解(见点5 b)。 ——一定要包括适当的控制(见5点)。 ——可能需要进一步的协议优化(见5点)。 |
表1:什么是观察兆瓦,其背后的原因是什么?

