必需氨基酸:图表、缩写和结构

氨基酸是构建块,最终形成多肽和蛋白质。因此,他们是我们的身体的基本组件和至关重要的蛋白质合成等生理功能,组织修复和营养吸收。我们仔细看看氨基酸属性,如何使用它们的身体和他们来自哪里。
内容
- - - - - -氨基酸的结构是什么?
——阿拉巴马州氨基酸
- - - - - - Arg氨基酸
——Asn氨基酸
——Asp氨基酸
-半胱氨酸的氨基酸
——Gln氨基酸
——Glu氨基酸
- - - - - - g氨基酸
——他的氨基酸
——Ile氨基酸
氨基酸-亮氨酸
氨基酸—赖氨酸
——遇到氨基酸
- - - - - -板式换热器氨基酸
- Pro氨基酸
——Ser氨基酸
——用力推氨基酸
——Trp氨基酸
- - - - - -酪氨酸的氨基酸
- Val氨基酸

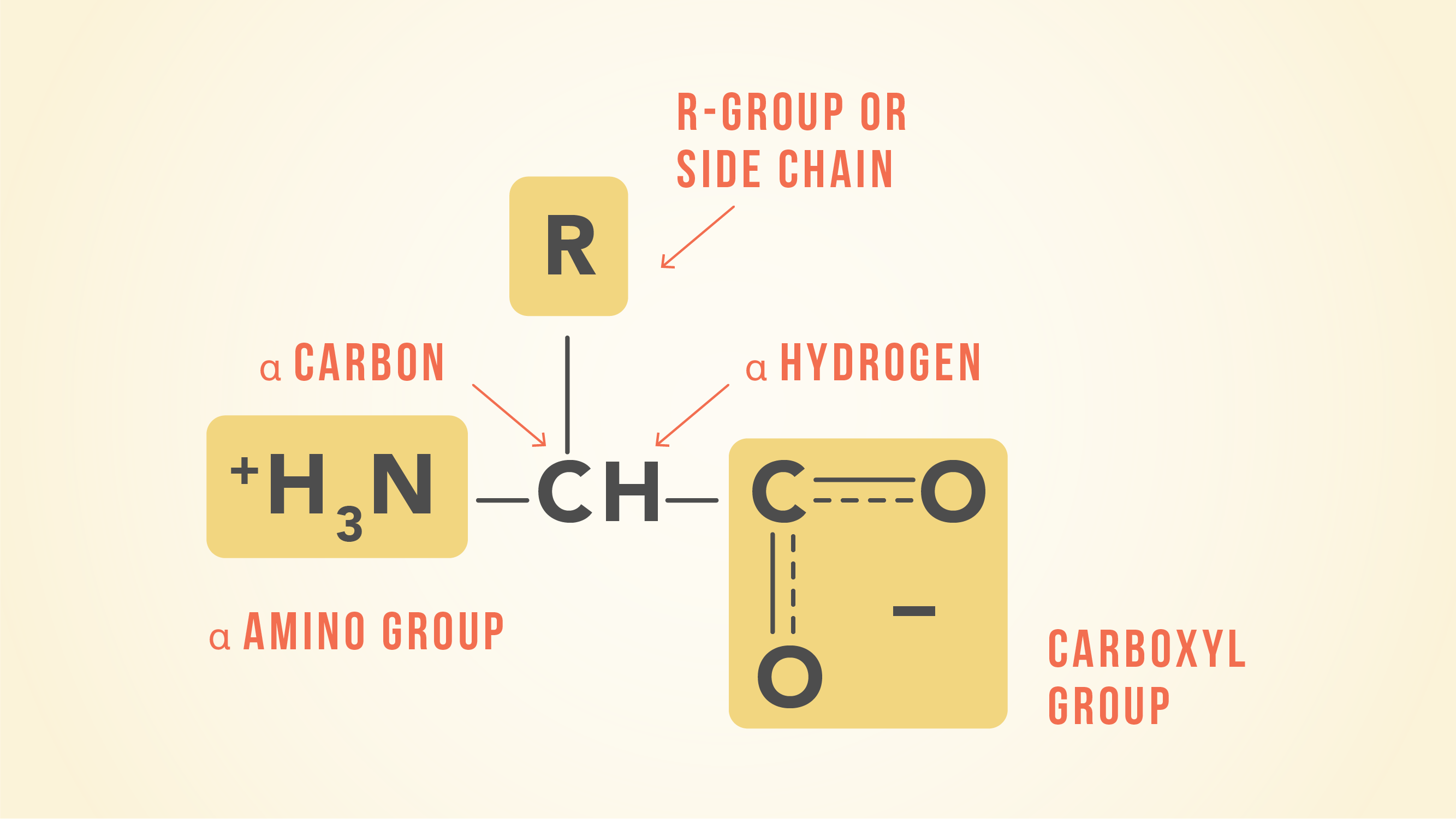
有20个氨基酸组成的蛋白质,都有相同的基本结构,不同的只是在r基团或侧链。
氨基酸的平衡两个酸质子(氢离子)在氨基和羧基之间移动,如下所示。

在这样的一个平衡,较弱的酸总是占了主导地位。比羧酸氨是一种较弱的酸,左边的平衡会说谎(“两性离子”的一面)。尽管氨基酸通常教科书作为右边所示结构,他们实际上主要是作为左手结构存在。
最简单的、最小的氨基酸是甘氨酸的r基团是氢(H)。他们可以再细分根据它们的属性,取决于他们拥有的官能团。广泛除以负责,疏水性和极性。这些属性影响他们与周围氨基酸多肽和蛋白质相互作用,从而影响蛋白质的三维结构和属性。

这个图表显示了化学结构的20种氨基酸组成的蛋白质。
氨基酸缩写
此表显示了缩写和单字母代码用于20种氨基酸中发现的蛋白质。此外,pyrrolysine,用于蛋白质的生物合成在一些古菌和细菌但不存在于人类,和硒代半胱氨酸、半胱氨酸模拟只发现在一些血统,都包含在蓝色。最后,缩写用于氨基酸残基与多个潜在的身份,和终止密码子是红色所示完成单字母缩写的字母。
氨基酸的结构是什么?
一个氨基酸的结构由一个碳原子连接中部一个氢,酸性羧基(−羧基),一个氨基(−NH2)和有机侧链(也称为R组)。的侧链的独特之处在于每一个20种氨基酸。
氨基酸 |
缩写 |
单字母缩写 |
丙氨酸 |
阿拉巴马州 |
一个 |
精氨酸 |
参数 |
R |
天冬酰胺 |
Asn |
N |
天冬氨酸 |
Asp |
D |
半胱氨酸 |
半胱氨酸 |
C |
谷氨酰胺 |
Gln |
问 |
谷氨酸 |
Glu |
E |
甘氨酸 |
通用电气 |
G |
组氨酸 |
他的 |
H |
异亮氨酸 |
Ile |
我 |
亮氨酸 |
低浓缩铀 |
l |
赖氨酸 |
利斯河 |
K |
蛋氨酸 |
见过 |
米 |
苯丙氨酸 |
板式换热器 |
F |
脯氨酸 |
箴 |
P |
丝氨酸 |
爵士 |
年代 |
苏氨酸 |
用力推 |
T |
色氨酸 |
Trp |
W |
酪氨酸 |
酪氨酸 |
Y |
缬氨酸 |
瓦尔 |
V |
Pyrrolysine |
所有供试 |
O |
硒代半胱氨酸 |
证券交易委员会 |
U |
天冬氨酸和天冬酰胺 |
澳交所 |
B |
谷氨酸或谷氨酰胺 |
Glx |
Z |
任何氨基酸 |
Xaa |
X |
亮氨酸、异亮氨酸 |
Xle |
J |
终止密码子 |
术语 |
阿拉巴马州的氨基酸
1875年发现的蛋白质,丙氨酸30%残留的丝绸。它的低反应性导致了简单,细长的丝很少有交叉连接结构使纤维强度、拉伸阻力和灵活性。只有l-stereoisomer参与蛋白质的生物合成。
Arg氨基酸
在人类中,精氨酸蛋白质消化时产生。它可以转换成人体一氧化氮,化学放松血管。
由于其血管扩张性效果,提出了精氨酸治疗慢性心力衰竭患者,高胆固醇,破坏循环和高血压,尽管在这些方面的研究仍在进行中。精氨酸也可以综合,arginine-related化合物可用于治疗肝脏功能障碍患者由于其在促进肝脏再生中的作用。虽然精氨酸的增长是必要的但不是身体保养,研究表明,精氨酸对愈合过程是至关重要的,尤其是在那些血液循环不良。
Asn氨基酸
1806年,天门冬素纯化芦笋汁,使其成为第一个氨基酸是孤立的从天然来源。然而,直到1932年,科学家们就能够证明天冬酰胺发生在蛋白质。只有l-stereoisomer参与哺乳动物蛋白质的生物合成。天冬酰胺是重要的从身体有毒的氨的去除。
Asp氨基酸
蛋白质中发现1868年,天冬氨酸通常被发现在动物蛋白质,但是只有l-stereoisomer参与蛋白质的生物合成。的水溶性氨基酸本身存在活跃的站点附近的胃蛋白酶等酶。
半胱氨酸的氨基酸
半胱氨酸是特别丰富的蛋白质头发,蹄,和皮肤的角质,从尿结石被孤立在1810年和1899年从角。随后,这是化学合成,结构解决了在1903 - 4。
半胱氨酸的含硫硫醇基侧链是其属性的关键,使两个肽链之间形成二硫桥(与胰岛素)或成圈在一个链,影响最终的蛋白质结构。两个半胱氨酸分子通过二硫键连接在一起组成氨基酸胱氨酸,有时单独列出的常见氨基酸上市。体内半胱氨酸是由从丝氨酸和蛋氨酸和只出现在l-stereoisomer在哺乳动物蛋白质。
患者的遗传条件胱氨酸尿无法有效地回笼胱氨酸进入自己的血液。因此,高水平的胱氨酸建立尿液中,结晶,形成的石头,阻止肾脏和膀胱。
Gln氨基酸
谷氨酰胺在1883年首次从甜菜汁分离,分离出一种蛋白质在1932年和随后合成化学。谷氨酰胺是我们身体中最丰富的氨基酸和执行一些重要的功能。在人类中,谷氨酰胺合成谷氨酸和这种转换步骤是至关重要的在调节体内有毒的氨的水平,形成尿素和嘌呤。
Glu氨基酸
谷氨酸是隔绝麦麸在1866年和1890年化学合成。常见的动物蛋白质,只有l-stereoisomer发生在哺乳动物蛋白质,人类能够从常见的中间α-ketoglutaric酸合成。l-glutamic味精盐的酸,谷氨酸钠(味精)是常用的调味品和增味剂。谷氨酸的羧基侧链可以作为供体和受体的氨气,这对身体是有害的,使氨的安全运输到肝脏,转化为尿素和由肾脏排泄。免费谷氨酸也可以降解为二氧化碳和水或转化成糖。
通用电气的氨基酸
甘氨酸是第一个从蛋白质氨基酸被孤立,在这种情况下,明胶,是唯一一个没有光学活性的(d -或l-stereoisomers)。α-amino酸的结构最简单,它非常稳定时纳入蛋白质。即便如此,甘氨酸是重要的丝氨酸生物合成的氨基酸,辅酶谷胱甘肽,嘌呤和血红素、血红蛋白的重要组成部分。
他的氨基酸
组氨酸孤立于1896年,其结构是在1911年经化学合成的。组氨酸是组胺的直接前体,也是一个重要的碳源合成嘌呤。当纳入蛋白质,组氨酸的侧链可以作为质子受体和捐赠者,传达重要的属性组合成酶如胰凝乳蛋白酶和那些参与碳水化合物的新陈代谢,蛋白质和核酸。
婴儿,组氨酸被认为是一个重要的氨基酸,成年人可以在短时间内没有饮食摄入量,但仍被认为是至关重要的。
Ile氨基酸
异亮氨酸是孤立的从1904年的甜菜糖糖浆。异亮氨酸的侧链的疏水性质决定蛋白质的三级结构是很重要的。
那些患有一种罕见的遗传疾病枫糖尿病,错误的酶降解通路中的常见异亮氨酸、亮氨酸、缬氨酸。如果不治疗,患者尿液中的代谢物积累贡献出状况的独特的气味。
低浓缩铀氨基酸
亮氨酸是孤立的从1819年奶酪和肌肉和羊毛在其1820年的结晶状态。在1891年,它在实验室合成。
只有l-stereoisomer出现在哺乳动物蛋白质和酶可以降解成简单化合物的身体。有些DNA结合蛋白质含有亮氨酸的区域安排在配置称为亮氨酸拉链。
赖氨酸氨基酸
赖氨酸在1889年首次从牛奶蛋白质分离酪蛋白,及其结构阐明在1902年。赖氨酸是重要的酶和辅酶的绑定方式的组蛋白功能中起着重要的作用。
许多谷类作物非常低赖氨酸导致缺陷在某些人口严重依赖这些食品和素食者和低脂节食者。因此,一直努力发展玉米株富含赖氨酸。
遇到了氨基酸
蛋氨酸在1922年从牛奶蛋白质分离酪蛋白,及其结构在1928年解决了实验室合成。蛋氨酸是一个重要的硫来源众多化合物在体内,包括半胱氨酸和牛磺酸。有关其含硫量,蛋氨酸有助于防止脂肪堆积在肝脏,并帮助解毒代谢废物和毒素。
蛋氨酸是必需氨基酸中唯一一个不存在的大量的大豆,因此产生商业和添加到许多豆粕产品。
板式换热器的氨基酸
苯丙氨酸是孤立的从天然来源(狼的豆芽)随后在1879年和1882年合成化学。人体是通常能够将苯丙氨酸分解成酪氨酸,然而与继承的个人条件苯丙酮酸尿(北大),执行这种转换的酶缺乏活动。如果不及时治疗,血液中苯丙氨酸的构建造成弱智儿童的心理发展。与条件,在10000年出生的孩子在生命的早期采用低苯丙氨酸饮食可以缓解的效果。
箴氨基酸
1900年,脯氨酸是化学合成。第二年就从牛奶蛋白质分离酪蛋白及其结构是相同的。人类可以从谷氨酸合成脯氨酸,只有当l-stereoisomer出现在哺乳动物蛋白质。脯氨酸纳入蛋白质时,其特殊的结构导致急剧弯曲,或缺陷,在肽链,更大地促进蛋白质的最终结构。脯氨酸及其衍生物羟脯氨酸,占21%的纤维状蛋白质胶原蛋白的氨基酸残基,结缔组织的重要因素。
Ser氨基酸
丝氨酸在1865年首次从丝蛋白分离,但其结构直到1902年才成立。人类可以从其他代谢物合成丝氨酸,包括甘氨酸,尽管只有l-stereoisomer出现在哺乳动物蛋白质。丝氨酸是重要的许多代谢产物的生物合成和酶的催化功能通常是重要的,包括胰凝乳蛋白酶和胰蛋白酶。
神经毒气和一些杀虫剂法结合的丝氨酸残基乙酰胆碱酯酶的活性部位,完全抑制酶。酯酶活性是至关重要的破坏神经递质乙酰胆碱否则建立高水平的危险,迅速导致抽搐和死亡。
用力推氨基酸
苏氨酸是在1935年从纤维蛋白分离和合成。只有l-stereoisomer出现在哺乳动物蛋白质,相对稳定。虽然在许多反应中重要的细菌,其代谢作用在高等动物,包括人类,仍不清楚。
Trp氨基酸
分离酪蛋白(牛奶蛋白)1901年,色氨酸的结构成立于1907年,但只有l-stereoisomer出现在哺乳动物蛋白质。饮食在人类肠道细菌分解色氨酸,释放化合物如粪臭素和吲哚给粪便他们不愉快的香味。色氨酸转化为维生素B3(也称为烟酸或烟酸),但不是以足够的速度来保持我们的健康。因此我们也必须摄取维生素B3,否则导致缺乏糙皮病。
酪氨酸的氨基酸
1846年酪氨酸是孤立的退化酪蛋白从奶酪(一种蛋白质),后在实验室合成及其结构在1883年决定。只出现在l-stereoisomer在哺乳动物蛋白质,人类可以从苯丙氨酸合成酪氨酸。酪氨酸是一个重要的先驱肾上腺激素肾上腺素和去甲肾上腺素,甲状腺激素包括甲状腺素和头发和皮肤黑色素。在酶,酪氨酸残基常与活跃的网站,改变可以改变酶的特异性或完全消灭活动。
遭受严重的遗传病苯丙酮酸尿(北大)无法转化为苯丙氨酸,酪氨酸,同时患者尿黑酸尿有一个有缺陷的酪氨酸代谢,产生独特的尿液,暴露在空气中就会暗淡。
Val氨基酸
缬氨酸的结构成立于1906年,于1879年首次从白蛋白被孤立。只有l-stereoisomer出现在哺乳动物蛋白质。缬氨酸可以退化为简单的化合物在体内,但在患有一种罕见的基因病枫糖尿病,一个错误的酶中断这一过程,如果未经处理的可以是致命的。
羧基的属性
疏水性氨基酸的性质
- 氨基酸的分类下,疏水性丙氨酸、缬氨酸、异亮氨酸、亮氨酸、蛋氨酸、苯丙氨酸、色氨酸和酪氨酸。
- 作为他们的分类表明,侧链往往是排斥水,这影响定位这些氨基酸的蛋白质三级结构。
极性氨基酸的性质
- 极性氨基酸残基通常是发现在蛋白质聚合后由于亲水侧链的属性。
- 四个氨基酸列为极但不带电(天冬酰胺,谷氨酰胺,丝氨酸和苏氨酸)。
芳香族氨基酸的性质
- 芳香族氨基酸(苯丙氨酸、酪氨酸和色氨酸),同时所有在其他分类,具有芳香侧链。
- 因此,不同程度,他们都吸收紫外线,酪氨酸吸收最和苯丙氨酸。


