(Ph)PINK1的新晶体结构有助于了解早发性帕金森病
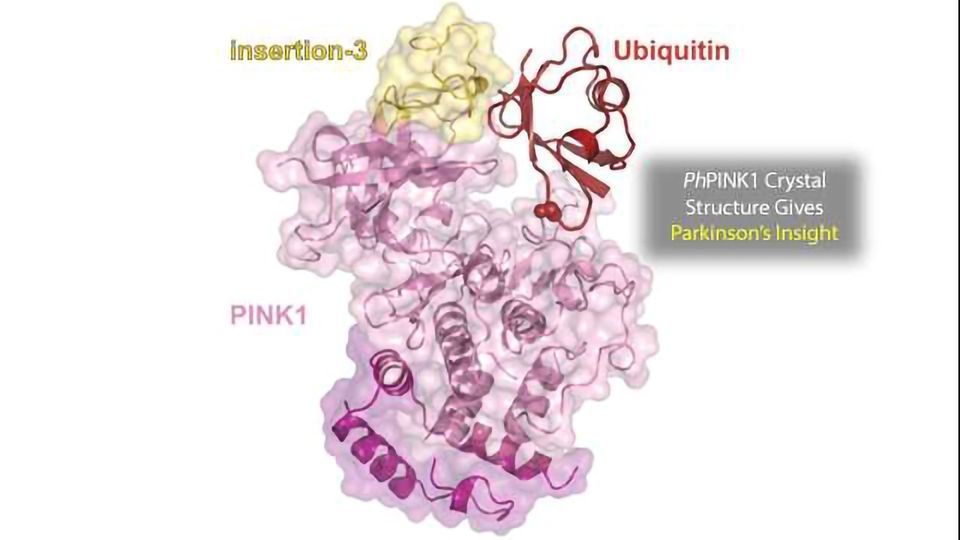
神经退行性疾病帕金森氏症通常在60岁以上的人群中发现,但大约10%的病例是这样的常染色体隐性少年由一种PARK基因突变引起的形式,其中15种已被注释。PINK1编码丝氨酸/苏氨酸激酶,是最早被发现的PARK基因之一,也是人类中分化程度最高的蛋白激酶之一。PINK1通过磷酸化小调节蛋白泛素触发受损线粒体的清除。最近,人们发现了一种新的泛素构象,称为泛素c -末端缩回构象(Ub-CR)。这个新泛素通过点突变(Ub TVLN)可以稳定构象,并且可以证明它与PINK1的结合比野生型具有更高的亲和力。此外,Ub-CR构象似乎是PINK1有效磷酸化所必需的。
尽管PINK1与其他人类蛋白激酶存在差异,但它在物种之间高度保守,导致鉴定出昆虫同源物(Ph)PINK1,它可以更容易地在实验室中表达用于实验目的。在最近的一项研究在一种稳定的纳米体的帮助下,科学家们能够确定与Ub TVLN结合的PhPINK1的晶体结构。该研究的第一作者亚历山大·舒伯特博士评论说:“尽管在过去的十年里,人们对PINK1进行了广泛的研究,但不可能将这种高度动态的蛋白质结晶化。因此,我们不了解这种不寻常的激酶是如何运作的,以及它是如何使泛素磷酸化的。另一方面,泛素也是一种非常不寻常的激酶底物,因为它的磷酸化位点(Ser65)不容易接近。PINK1在早发性帕金森病中高度突变,有了这种结构,我们将能够在分子水平上理解几种患者突变,并可能指导帕金森病治疗方法的设计。”
这种复杂的结构有助于了解40多种PINK1突变的分子基础,这些突变可能导致导致帕金森病的有害变化。人们希望这些信息能够帮助设计帕金森病的治疗方法。Alex总结道:“将PINK1的活性构象结构与其底物泛素结合是开发激活PINK1的小分子的一个很好的起点。我们非常乐观地认为,我们的结构将指导未来治疗早发性帕金森病的药物设计。”在更广泛的背景下,该结构还揭示了激酶家族如何与其底物相互作用的信息,激酶家族本身就是一个主要的药物靶点,为改善许多使人衰弱的疾病的治疗打开了大门。
参考
PiNK1及其底物泛素复合物的结构Alexander F. Schubert, Christina Gladkova, Els Pardon, Jane L. Wagstaff, Stefan M.V. Freund, Jan Steyaert, Sarah L. Maslen和David Komander。Nature http://dx.doi.org/10.1038/nature24645(2017)。




