Ras途径和癌症:监管、挑战和治疗进展

多年来,Ras信号通路引发了希望和失望在癌症研究领域。在正常健康,Ras信号是胞内信号网络的监管核心参与细胞增殖、生长和存活。然而,像许多细胞信号通路,Ras-related级联也有黑暗的一面。突变拉在上游或下游基因本身,或监管机构,可以推动通路持续活跃,致癌的状态。
在最近的一次分析的主要癌症突变数据库,据估计,大约19%的癌症患者拉突变——相当于340万新癌症病例,每年全球。1因此,寻找抑制异常的Ras信号仍然是一个关键的研究重点。2
Ras信号通路是什么?
h - k - ras基因和基因密切相关的蛋白质,经常突变在人类癌症。具体地说,它们是不同的亚型小、鸟苷三磷酸酶(gtpase)函数作为二进制开关在所有哺乳动物细胞。通常,Ras蛋白紧密控制,移动之间的一个活跃的(绑定到三磷酸鸟苷三磷酸鸟苷)和非活动状态(绑定到鸟苷二磷酸,GDP)。当了”“他们引发复杂的信号级联,能传感细胞生存和生长的信号。 3 虽然Ras功能监管在很多层面上,核心途径包括Ras,英国皇家空军(迅速加速纤维肉瘤),MEK(增殖细胞外signal-regulated激酶)和ERK1/2(细胞外signal-related激酶1和2)。通常被称为Ras-Raf-MEK-ERK级联(图1),是中央,进化保存路径传输信号从细胞表面受体下游转录因子目标通过以下序列 : 3
- 绑定的表皮生长因子(EGF) EGF受体激活鸟嘌呤交换因素(例如,SOS)加载和三磷酸鸟苷Ras。
- Ras-GTP新兵Rafs或皇家空军/ MEK质膜形成。
- RAF mek组件激活皇家空军。
- 活跃的英国皇家空军二聚体激活MEK。
- 激活mek使磷酸化erk(一群增殖蛋白激酶,MAPK)。
- ERK磷酸化不同底物参与细胞增殖、生存、生长、代谢、迁移和分化。
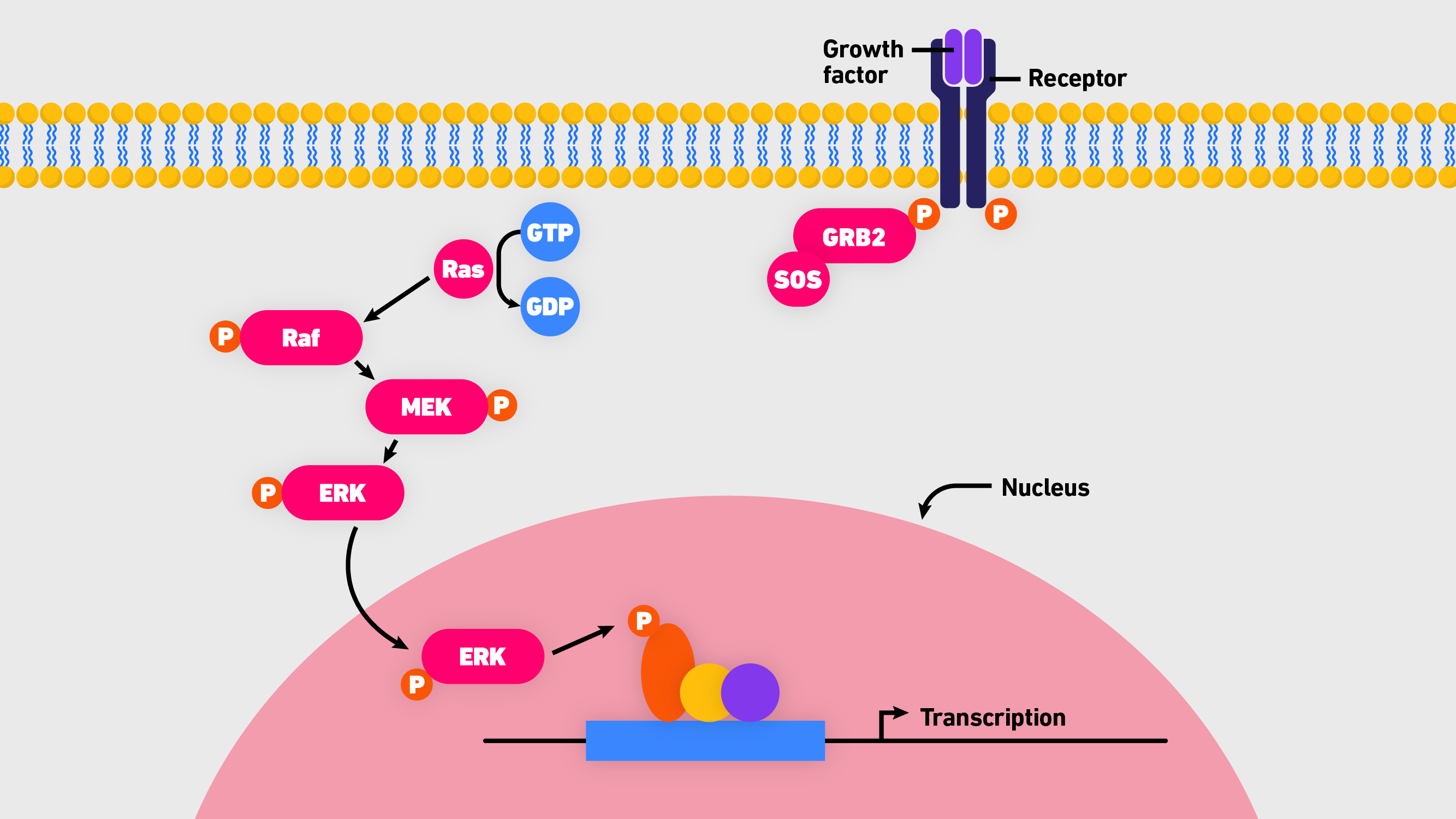
图1:概述Ras-Raf-MEK-ERK级联。
Ras-Raf-MEK-ERK级联是一个复杂的途径,不仅因为它是淹没在缩略词。一个术语常常用来指定多个亚型;Ras和英国皇家空军各有三个亚型,MEK可以作为MEK1存在或MEK2,而ERK指ERK1和ERK2。4,5,6Ras的调节信号通路也复杂;除了EGF之外,还有其他的受体酪氨酸激酶(rtk)影响路径的能力。“与现有的反馈在多个水平,细胞可以绕过或选择额外的突变获得耐药性,”说玛丽·帕森斯医学博士后,威尔康奈尔医学。下游,ERK调节250多个基板包括转录因子、蛋白激酶和磷酸酶,细胞骨架元素和细胞凋亡的监管机构。7
Ras信号如何成为提供导致癌症?
当永久Ras开关“上”,由此产生的本构信号提供了增殖信号,使肿瘤发生。这种本构状态会导致突变基因编码的关键蛋白质的途径,包括Ras本身。“放松管制网络的最常发生在Ras激活突变或RTK-Ras信号通路”说玛丽娜Pajic副教授和实验室负责人,个性化的癌症治疗实验室Garvan医学研究所的。Pajic指cBioPortal癌症基因组学和癌症基因组图谱(TCGA)——这两个拥有大规模癌症基因组数据集,使模式识别和量化。例如,一个TCGA-based研究展示了RTK-Ras通路中值频率最高的突变在所有癌症类型,与突变中发现46%的人类癌症。8
拉基因是人类癌症中最常见的突变基因,与单一突变相关,通常在密码子12日13日或61年,所有这些活动(GTP-bound) Ras的形成。9,10尽管类似功能的后果,并不是所有的Ras突变体都是平等的,发生在不同的频率:k - Ras基因是主要的变异同种型(85%),其次是n - (11%)。11“在某些癌症,如胰腺导管腺癌(PDAC), k - ras基因突变激活是最频繁发生的变更。当我们12,13,14和其他人15表明,突变激活吗喀斯特发现在94%的情况下,是一个主要的贡献者治疗抵抗,“Pajic说。与此同时,国家管制当局方面突变在黑色素瘤占主导地位。16,17作为拉突变通常是组织抑制剂,工作在一个癌症类型往往不会在别人工作,帕森斯解释说:“例如,表皮生长因子受体抑制剂通常更成功的黑色素瘤结直肠癌可以解释为其他突变因素。”
而拉是最常见的突变,改变也可以发生在不同的或多个阶段的途径;大约60%的非小细胞肺癌在“司机致癌基因”包括有改变表皮生长因子受体,BRAF和喀斯特。18同时,90%的胰腺癌有关喀斯特突变,19和大部分的甲状腺癌拉或BRAF突变体。20.总的来说,持续活跃Ras-Raf-MEK-ERK途径会导致不同的结果,作为通路控制遗传程序与细胞生长有关,迁移,生存和细胞周期。21
困难与靶向Ras途径有关
目前,没有可用的治疗方法专门为Ras突变的癌症。缺乏临床成功,加上臭名昭著的困难与目标相关的通路,使Ras开发一个名声是一种无药可治”“目标。而无药可治”“标题正在挑战,关键障碍和复杂性仍然存在 : 22 , 23
- Ras的拓扑的设计并不适合高亲和性的药物,因为它缺乏一个可访问的口袋里。
- 突变的蛋白质是几乎相同的本质,野生型。
- 野生型Ras亚型可以致癌Ras蛋白相互作用显示肿瘤促进和抑制肿瘤的功能。
“通路非常棘手的目标,特别是由于细胞迅速克服封锁的能力,和激活下游信号通过或并行机制,“反映出Pajic。帕森斯补充说:“虽然一直努力开发小分子抑制剂——其中一些是在诊所,他们常常遇到阻力,和细胞持续找到一个方法来诱导信号即使在抑制剂的存在。很多抑制剂还会见了变量反应的病人。”
无药可治失去“”的标签:最近Ras-targeted疗法的成功和发展
经过长时间的挫折, 最近成功 产生了新的活力。承诺二期结果观察到喀斯特G12C抑制剂叫sotorasib / AMG 510肿瘤导致快速和持久的铸件在以前治疗晚期非小细胞肺癌患者。 24 “现在我们已经看到它是可能的,”帕森斯表示,“我认为许多努力改善这种抑制剂将进行。12 c抑制剂并不完美和论文已经显示阻力,但我认为基本概念将开门的发展改进抑制剂增加疗效。公司将保留此信息保密,但我认为很多人会建立最初的发现。“小分子药物是第一个喀斯特G12C抑制剂进入诊所,可以抑制喀斯特信号和肿瘤细胞系和patient-derived异种移植模型。 25
细胞发现产生耐药性的新方法,研究人员寻求新的工具和方法——往往不仅仅是一个单一的解决方案。例如,在黑色素瘤中使用MEK抑制剂与BRAF抑制剂已被证明减缓耐药性的收购。 26 Pajic指向其他一些发展,包括临床级的生产 “iExosomes”(间充质基质细胞衍生液KrasG12D siRNA) PDAC,喀斯特效应器的目标等PTPN11first-in-human研究进行先进的固体癌症患者(例如, NCT04528836 , NCT04252339 )。 27 牧师和他的同事们也在探索联合疗法的临床前模型,并描述了喀斯特12 c抑制剂和表皮生长因子受体抑制剂导致细胞死亡体外。 28
Ras-targeted疗法都涉及一些新奇的复兴化合物最初被视为失败。raf mek抑制剂的发展CH5126766起初看起来有前途,但被毒性问题。探索潜在的方式限制毒性,抑制剂是描述在一个阶段我研究使用间歇计量时间表。 29日 总的来说,它被认为抗肿瘤活性实现跨多个癌症类型,和抑制剂被认为是可容忍的——raf mek抑制剂的需要进一步评估。
持久,创造性思维是这个领域的需求,这正是Pajic 的组织工作。通过探索的使用 小说,小分子,stroma-targeting代理Pajic希望剥夺癌细胞的支持基质利基在原发灶和转移,同时支持化疗和/或immuno-oncology代理。 30. , 31日
精确,小说肿瘤所需的工具和临床前模型驱动Ras-related疗法的发展。帕森斯,她的任务是开发更具代表性动物模型对于结直肠癌,随着许多当前模型的发展在小肠肿瘤。同时,同事和作者玛丽亚Zafra使用基础编辑与特定使小鼠出现不同的变化喀斯特突变——现在发表在癌症的发现: 28 “老鼠和后续瀑样文化是一个非常有价值的工具,它忠实地概括信号动态,和作为一个重要的临床前模型。以前,大多数研究将使用细胞系删除很多信号的复杂性,”帕森斯说。在同一个实验室,记者是来指示准确时,诱导基本编辑。“这将是非常令人兴奋的,你可以介绍一个特定的突变,然后“关掉”交付系统,以避免长期或脱靶效应,”帕森斯解释说。工作打开门实现CRISPR基地编辑创建有针对性的突变细胞系,瀑样和动物模型。 32
从喀斯特G12C抑制剂的勘探突破的联合疗法,Ras-related研究的重大进展。一起,临床前研究工具等基本编辑记者,瀑样和精确的动物模型是为理性的发展铺平了道路,为抗癌策略。
“除了我认为基因工程领域一般向前推动这一领域,”帕森斯说。“临床前模型正在开发的快速变化使模型更具有代表性。我们可以诱导突变瀑样改变和CRISPR /基础编辑字段是在这样一个快速发展。许多公司也变得越来越聪明与药物设计和建筑在现有药物像12 c抑制剂。”
引用
1。IA之前,罩铁、哈特利杰。Ras突变在癌症的频率。癌症Res。2020;80 (14):2969 - 2974。doi:0008 - 5472. - 10.1158 / - 19 - 3682
2。Ghobrial IM, Adjei AA。Ras抑制剂致癌基因治疗靶点。内科杂志杂志中国北部。2002;16 (5):1065 - 1088。doi:10.1016 / s0889 - 8588 (02) 00050 - 3
3所示。Chang F,斯蒂尔曼LS,李JT, et al .信号转导的Ras /皇家空军/ MEK / ERK通路从细胞因子受体转录因子:治疗干预的潜在目标。白血病。2003;17 (7):1263 - 1293。doi:10.1038 / sj.leu.2402945
4所示。Rebocho美联社,Marais r . ARAF充当支架稳定BRAF: CRAF形成。致癌基因。2013年,32 (26):3207 - 3212。doi:10.1038 / onc.2012.330
5。史密斯Caunt CJ、销售乔丹,PD, SJ做饭。MEK1 MEK2抑制剂和癌症治疗:漫长而曲折的道路。Nat牧师癌症。2015;15 (10):577 - 592。doi:10.1038 / nrc4000
6。战战兢兢的R, Pouyssegur J, Lenormand p ERK1 ERK2 MAP激酶:特定角色或功能冗余?前细胞Dev杂志。2016;4。doi:10.3389 / fcell.2016.00053
7所示。Yoon年代,塞格尔r .细胞外signal-regulated激酶:多种基质调节细胞功能的多元化。生长因子。24 (1):2006;21-44。doi:10.1080 / 02699050500284218
8。Sanchez-Vega F,米娜,亚美尼亚J, et al .致癌信号通路在癌症基因组图谱。细胞。2018,173 (2):321 - 337. - e10。doi:10.1016 / j.cell.2018.03.035
9。斯科特•AJ代替CH,梅瑟史密斯对比佤邦。治疗方法RAS突变。癌症杂志。2016;22 (3):165 - 174。doi:10.1097 / PPO.0000000000000187
10。昆兰MP, Settleman j . Isoform-specific Ras功能开发和癌症。未来的杂志。2009;5 (1):105 - 116。doi:10.2217 / 14796694.5.1.105
11。霍布斯GA、Der CJ -罗兹曼KL。拉亚型和突变在癌症。J细胞科学。2016,129 (7):1287 - 1292。doi:10.1242 / jcs.182873
12。贝利P, Chang DK,等。基因分析识别分子亚型的胰腺癌。自然。2016,531 (7592):47-52。doi:10.1038 / nature16965
13。Waddell N,尹浩然,Pajic。整个基因组重新定义胰腺癌的突变景观。自然。2015,518 (7540):495 - 501。doi:10.1038 / nature14169
14。Biankin AV, Waddell N, et al .胰腺癌基因揭示畸变在轴突引导途径的基因。自然。2012,491 (7424):399 - 405。doi:10.1038 / nature11547
15。琼斯年代,张X,帕森斯DW, et al .核心信号通路在人类胰腺癌揭示了全球基因组分析。科学。2008,321 (5897):1801 - 1806。doi:10.1126 / science.1164368
16。Stalnecker CA, CJ。RAS,想死或活:针对RAS突变的癌症进展。Sci的信号。2020;13 (624):eaay6013。doi:10.1126 / scisignal.aay6013
17所示。考克斯广告、Fesik SW Kimmelman AC,罗J, CJ。用药无药可治的RAS:任务可能吗?Nat牧师药物越是加大。2014;13 (11):828 - 851。doi:10.1038 / nrd4389
18岁。吴扎曼,Bivona。针对致癌BRAF:过去、现在和未来。癌症。2019;11 (8):1197。doi:10.3390 / cancers11081197
19所示。布卢姆,王P, Zenklusen JC。快照:TCGA-analyzed肿瘤。细胞。2018年,173 (2):530。doi:10.1016 / j.cell.2018.03.059
20.癌症基因组图谱的研究网络。集成化的乳头状甲状腺癌基因特征。细胞。2014;159:676 - 690。doi:10.1016 / j.cell.2014.09.050
21。Gimple RC,王x RAS:致癌电路的核心。前肿瘤防治杂志。2019;9:965。doi:10.3389 / fonc.2019.00965
22。麦考密克f .直接针对喀斯特。为癌症杂志。2018;8:81 - 90。doi:10.1146 / annurev - cancerbio - 050216 - 122010
23。周B, Der CJ,考克斯广告。野生型拉的作用在癌症亚型。Semin细胞Dev杂志。2016;58:60 - 69。doi:10.1016 / j.semcdb.2016.07.012
24。斯特里克勒JH香港DS, Fakih毫克,et al .喀斯特G12C抑制与sotorasib先进的实体肿瘤。N拉米夫地中海。2020;383 (13):1207 - 1217。doi:10.1056 / NEJMoa1917239
25。佳能J, K雷克斯,Saiki哦,等。临床喀斯特(G12C)抑制剂AMG 510驱动器抗肿瘤免疫力。自然。2019,575 (7781):217 - 223。doi:10.1038 / s41586 - 019 - 1694 - 1
26岁。厄罗古鲁Z, a里巴斯与BRAF和MEK抑制剂联合治疗黑色素瘤:最新证据和在治疗。其他副词医学杂志。2016;8 (1):48-56。doi:10.1177 / 1758834015616934
27。原来哒,Heynen GJ, Ciecielski KJ, et al .突变KRAS-driven癌症取决于PTPN11 / SHP2磷酸酶。Nat地中海。2018;24 (7):954 - 960。doi:10.1038 / s41591 - 018 - 0024 - 8
28。Zafra MP,帕森斯MJ,金正日J,等。体内喀斯特共同致癌的等位基因系列显示不同的表型变异。癌症越是加大。2020;10 (11):1654 - 1671。doi:2159 - 8290. - 10.1158 / cd - 20 - 0442
29。郭C, Chenard-Poirier M,又D, et al .间歇性时间表的口头raf mek抑制剂CH5126766 / vs - 6766在RAS / RAF-mutant固体肿瘤和多发性骨髓瘤患者:一个只有,非盲、第一阶段剂量递增和篮子dose-expansion研究。《柳叶刀》杂志。2020;21 (11):1478 - 1488。doi:10.1016 / s1470 - 2045 (20) 30464 - 2
30.帕金,男人J, Timpson P, Pajic m .针对Src的复杂性在胰腺癌的肿瘤微环境信号:从治疗的机制。2月J。2019;286 (18):3510 - 3539。doi:10.1111 / febs.15011
31日。Vennin C,墨菲KJ,莫顿JP,考克斯TR, Pajic M, Timpson p .重塑治疗胰腺癌的肿瘤间质。胃肠病学。2018,154 (4):820 - 838。doi:10.1053 / j.gastro.2017.11.280
32。Katti, Foronda M,齐默尔曼J, et al .:编辑功能记者系统识别和丰富基地活动。核酸Res。2020年,48 (6):2841 - 2852。doi:10.1093 / nar / gkaa124





