XL-MS和低温电子显微镜的给予和获得的关系

结构生物学最近观察到的两个显著的结婚免费技术研究蛋白质结构和交互:交联质谱(XL-MS)和诺贝尔奖获得者低温电子显微镜(低温电子显微镜)。作为一个“权力”夫妇,他们共同努力,克服各自的缺点。当分子区域不太好定义在低温电子显微镜图像,XL-MS步骤提供关键信息的特定氨基酸残基的距离,使识别的蛋白质和蛋白质结构的准确演绎。这里,我们仔细看看这些技术的发展,如何在一起,他们将推动结构蛋白质组学领域的一个新时代。
一个组装机器的蓝图
蛋白质及其复合物的生物“主力”细胞,调节过程不可或缺的细胞功能如细胞生长、细胞死亡和细胞的生命周期的每个阶段。
“我喜欢比较蛋白质结构的蓝图组装机器,”说克里斯蒂娜Paulino在高分辨率的低温电子显微镜助理教授格罗宁根大学在最近的一次,面试。“虽然遗传学和生物化学有助于理解蛋白质的生理作用是什么,结构生物学揭示这些纳米是什么样子以及它们是如何连接的。”
知识的“布线”因此介绍科学家的机会修复蛋白质,工程师和复制他们或潜在块功能蛋白质组学的应用,预计将是个性化药物不可或缺,现代药理学。
XL-MS工具箱女士的一个关键组件
生物学中一个基本原则是,蛋白质由氨基酸残基由肽键相连形成多肽。除了肽债券,非共价债券,如范德华力、静电和疏水相互作用也存在。在结构生物学,这些债券难以检测,添加一个额外的复杂性,研究蛋白质结构层在原子水平。在过去的十年中,蛋白质组学领域发生了一系列令人印象深刻的技术添加到工具箱女士。XL-MS就是这样一种技术,已经被证明不可缺少的结构蛋白质组学。1
图1总结了一个典型的XL-MS工作流,非共价相互作用蛋白质(或接近)转换为人工共价键通过增溶的本机蛋白质交联试剂。由于其发病率,稳定水解决方案和高反应活性,赖氨酸残基的伯胺组或蛋白质的n端频繁cross-linkers目标。等在这里,homobifunctional cross-linkers disuccinmidyl辛二酸盐(DSS)和bis (sulfosuccinimidyl)辛二酸盐是最常见的。2交联后的阶段,蛋白质加工,切成肽蛋白酶。
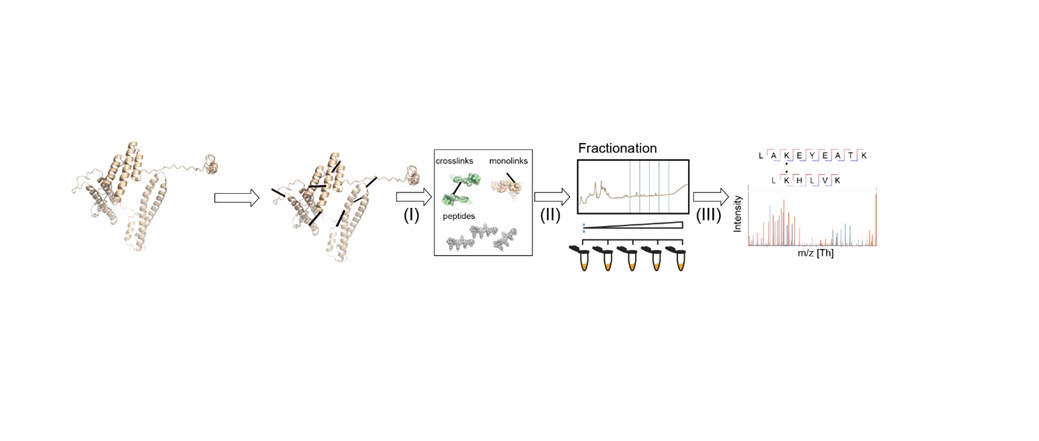
“混合女士随后测量的识别,在大多数情况下,氨基酸参与交联可以分配给我们提供一个距离约束定义为间隔臂的长度和两个侧链,”解释道理查德Scheltema博士的见鬼的实验室在乌得勒支大学。“这些距离约束提供有价值的信息关于蛋白质折叠(两个肽来自相同的蛋白质)或蛋白质交互和界面的交互所在地(两个来自不同的蛋白质的肽)。”
通常情况下,结构解析通过XL-MS 15至50——没有匹配的决议获得通过替代结构生物学技术如x射线晶体学、核磁共振(NMR)谱当然,低温电子显微镜,因此为什么必须使用的技术相互补充。3
低温电子显微镜提供了一项决议
从透射电子显微镜(TEM),低温电子显微镜确定三维(3 d)结构从二维(2 d)图像投影,同时保持结构的完整性和示例close-to-native状态。这是通过研究样本玻化状态,即薄滑的样本正在迅速陷入了液态乙烷浴,低温保存和保护它从真空在TEM和辐射损伤。4Paulino讨论的优势比其他结构生物学技术进一步采用低温电子显微镜在这里。
XL-MS中的交联数据描述两个特定的氨基酸残基之间的最大距离肽。提出结构模型的蛋白质及其域安插进重建3 d体积通过低温电子显微镜,和交联数据集成验证特定的位置和方向肽蛋白复合物。
最近,亨利等。确定活动的结构和绑定机制的载脂蛋白E4 (ApoE4)。与阿尔茨海默病(AD)和心血管疾病(CVD)、载脂蛋白的ApoE4是lipidated对碘氧基苯甲醚(ApoE),一种蛋白质,促进胆固醇的内化丰富脂蛋白作为配体的细胞表面受体。采用混合方法将XL-MS、低温电子显微镜和生物信息学建模工具,亨利et al。表明ApoE4存在于两个交替确认,指向一个激活机制依赖于监管的可访问性受体结合区域。作者指出,这些发现可能有价值的解释蛋白质的作用在广告和CVD和随后的潜在疗法的发展。6
类似的令人印象深刻的努力由施密特和Urlaub全面概述了2017年审查,包括剪接体的结构特征鲁曼和鲜明的群体。3
今年1月,荷兰科学研究组织(NWO)授予€160万欧元的资助项目题为监控和可视化蛋白质细胞中的社会行为XL-MS和低温电子显微镜技术,在其他分子的方法,共同使用。主要调查人员的项目看到了建立团队,包括艾伯特见鬼,约翰•范德东亚历山大•Bonvin弗里德里希·福斯特把Scheltema地图和可视化蛋白质间的相互作用。
“在这个项目中,我们的目标是使用cryo-tomography专业应用低温电子显微镜,无偏发现在一组选择的嗜热微生物蛋白复合物。这里使用XL-MS提供身份和空间的顺序确定内的蛋白质复合物(通常不能直接回答的断层扫描数据)和结构造型填写最后的差距。”Says Scheltema "The thermophiles were selected as these organisms are a potential treasure trove for protein complexes with biochemical use."
重新定义的局限性和向前发展
XL-MS和低温电子显微镜提供极大地推进结构蛋白质组学领域的潜力。然而,他们每个人都面对他们自己的局限性,必须克服形成一个完美的伙伴关系。
“低温电子显微镜是不断重新定义它的局限性,然而我们仍然面临着一些挑战,“Paulino评论。“而对于x射线晶体学,获得全面运作和维护同步加速器束线主要是可用的和免费的,低温电子显微镜的整体成本和所需的专业知识水平操作显微镜是一个障碍。这在某种程度上,但不完全,由政府补贴的实施解决低温电子显微镜设施”。
“Cryo-tomography提供较低分辨率的看法的蛋白复合物直接解释是很困难的。”Scheltema adds "The data from XL-MS on the other hand provides a view of everything that exists in solution with spatial information. However, linking these two provides I think the biggest challenge because XL-MS delivers information on all proteins in the sample, which needs to somehow be filtered for proteins inside the complexes unveiled by tomography."
引用:
1。Rappsilber,想把它们做为》2011。一段美好友谊的开始:交联/质谱和多蛋白复合体的蛋白质和造型。结构生物学杂志》上。https://doi.org/10.1016/j.jsb.2010.10.014。
2。Yu和黄》2017。交联质谱(XL-MS): Interactomics和结构生物学的新兴技术。分析化学。https://doi.org/10.1021/acs.analchem.7b04431。
3所示。施密特和Urlaub》2017。结合低温电子显微镜(低温电子显微镜)和质谱(CX-MS)的交联结构说明大型蛋白质组装。当前结构生物学的观点。https://doi.org/10.1016/j.sbi.2017.10.005。




