前沿技术揭示与帕金森病相关的蛋白质
一种难以捉摸的蛋白质,许多人认为它是充分理解遗传性帕金森病病因的关键,如今它已经更加清晰地成为人们关注的焦点。
帕金森症影响着全球数百万人,是一种神经系统疾病,会逐渐攻击运动功能,导致运动和协调等方面的持久损伤。
研究该疾病主要原因的研究人员主要关注一种名为富亮氨酸重复激酶2 (LRRK2)的蛋白质的突变。由于缺乏蛋白质结构的信息,了解LRRK2是如何破坏正常功能的一直很困难。由于LRRK2是一个主要的药物靶点,破译LRRK2结构的努力甚至包括将样本发射到太空中,作为一种利用微重力条件帮助蛋白质样本结晶的方式,但没有成功。
现在,加州大学圣地亚哥分校的科学家们利用前沿技术,首次在其自然细胞环境中对LRRK2进行了可视化,并绘制了该蛋白质的第一张高分辨率蓝图。他们利用这些描述来描述LRRK2如何与称为微管的细胞轨道结合,并作为沿着这些轨道移动的马达的路障。该研究结果发表在两篇发表在期刊上的研究论文中细胞而且自然.
“这两篇论文为开发更有效的帕金森病治疗方法迈出了巨大的一步,这种疾病影响了许多人的生命,”生物科学系主任Kit Pogliano博士说,他是分子生物学部门的教授。“将冷冻电子显微镜与活细胞成像相结合,可以让研究人员看到细胞内的蛋白质工作,并更快地确定潜在药物是如何影响它们的功能的。这将加速药物的发现,并为那些患有这种使人衰弱的疾病的人带来新的希望。”
LRRK2:帕金森病的关键治疗靶点
LRRK2被称为激酶,是一种将磷酸盐化学标记添加到其他蛋白质上的酶,影响它们的功能。LRRK2突变是遗传性帕金森病的主要原因,但研究人员并不完全了解这种酶在正常情况下或疾病状态下的功能。
这些问题的答案一直在积极寻求,特别是因为激酶是治疗学最确定的药理学靶点之一。自从LRRK2基因在2004年首次被克隆以来,人们投入了大量的努力来针对它治疗帕金森氏症。
苏珊泰勒,世界知名的激酶权威,认识到加州大学圣地亚哥分校的专业知识是解决这个问题的理想选择。在迈克尔·福克斯基金会一个国际团队,包括加州大学圣地亚哥分校的研究人员,开始使用新技术研究LRRK2。
微管上LRRK2的细胞蓝图
正如《细胞》论文中所描述的那样,由Elizabeth Villa博士和她的同事领导的加州大学圣地亚哥分校的研究人员利用新的突破性技术,即冷冻电子断层扫描(cro - et),一种冷冻电子显微镜(cro - em)的方式,在细胞内的自然环境中观察LRRK2,并在以前从未见过的水平上描述其结构。
在许多情况下,当研究人员试图确定蛋白质的结构时,他们首先从细胞外分离蛋白质开始。当使用低温电子显微镜时,科学家们将分子冻结在一层薄冰中,保存它们的结构,并以高分辨率确定它们的结构。相反,维拉的团队对含有所研究分子的冷冻细胞进行成像,从不同的角度拍照,有点像CAT扫描。
维拉说:“我们打开罩盖,观察细胞内部细胞中不同地方相互作用的冷冻分子。”他指出,与赛默飞世尔科学公司和加州大学圣地亚哥分校共同开发这项研究中使用的尖端仪器的重要性,他们在校园内建立了一个新的冷冻电镜设施。“我们用电子束和离子束像光剑一样炸开了细胞的一部分。在中间我们留下一个窗口,里面有我们感兴趣的分子。”
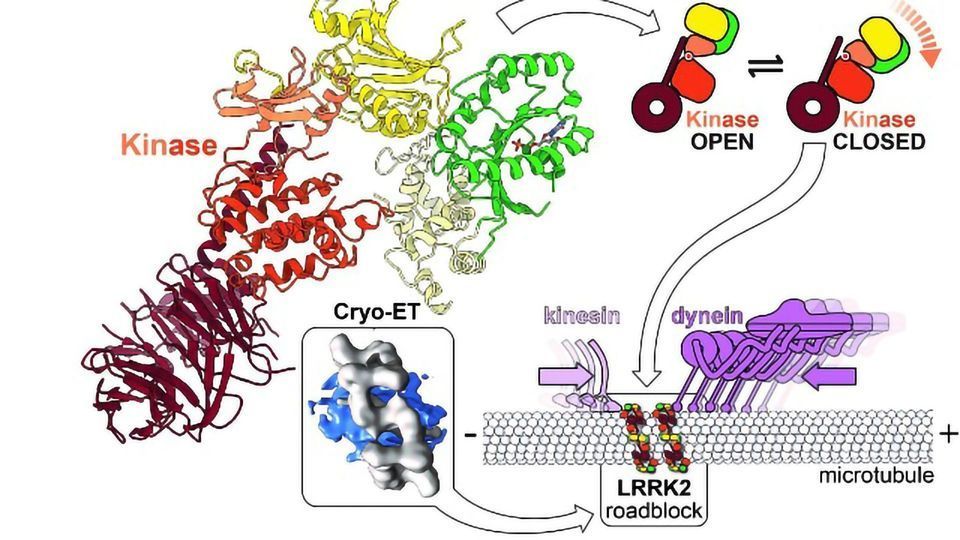
研究人员还使用光学显微镜来发现细胞内的分子,并使用先进的计算建模工具来开发突变体LRRK2的高分辨率综合模型。他们的数据显示,LRRK2结合在被称为微管的细胞高速公路上,以惊人的规则和意想不到的几何形状装饰它们,并预测LRRK2的激酶类似于已知发生在帕金森病中的“超速”状态。
维拉说:“这项研究首次应用了这种强大的新技术的组合,使我们有可能初步了解突变体LRRK2的结构,并获得其细胞环境的额外好处。”“据我们所知,这是在使用传统生化工具之前在细胞内确定的最高分辨率的人类蛋白质结构。我们正在给细胞生物学带来结构。”
LRRK2的分子蓝图
为了了解LRRK2在化学水平上的工作原理并设计治疗方法,需要更高分辨率的结构来揭示原子的位置以及它们如何与潜在药物相互作用。在《自然》杂志的研究中,共同资深作者Samara Reck-Peterson博士和Andres Leschziner博士更深入地研究了LRRK2的结构和功能,并与Villa的团队合作确定了LRRK2如何与微管相互作用。
利用低温电子显微镜,Leschziner的团队捕捉到了迄今为止LRRK2结构最详细的图像,精确到原子水平。德国法兰克福歌德大学教授Stefan Knapp和他的团队在确定如何使LRRK2易于处理结构工作时也发挥了重要作用。该结构包括蛋白质的业务端,其中包括用磷酸盐标记其他蛋白质的部分。所有引起帕金森病的主要突变的位置都在它们的结构中找到。
接下来,Leschziner小组将他们的结构与Villa的结构结合起来,提出了一个解释LRRK2如何与微管结合的模型。
“你可以把LRRK2的激酶部分想象成有点像吃豆人,它可以是开放的,也可以是封闭的,”加州大学圣地亚哥分校医学院和生物科学部的教授Leschziner说。“我们的模型表明,当与微管结合时,激酶需要处于封闭状态,这表明激酶的形状可能调节LRRK2与微管的结合。我们与Reck-Peterson实验室合作,决定直接测试这个模型。”
LRRK2是分子马达的绊脚石
微管是Reck-Peterson的专长。她和她的团队对沿着微管运输货物的分子马达感兴趣,以及这种运输中的缺陷如何导致人类神经发育和神经退行性疾病。Reck-Peterson和她的团队想知道LRRK2与微管的相互作用是否会对在微管上移动并在细胞中从一个地方到另一个地方携带基本货物的分子机器有害。
她的团队发现LRRK2会制造阻碍这些分子机器的路障。他们还表明,一些靶向LRRK2激酶的药物增强了这种效果,而其他药物则减弱了这种效果。虽然Leschziner和Reck-Peterson还不确定障碍是否在帕金森病中发挥作用,但他们的发现已经对设计通过抑制LRRK2起作用的治疗药物产生了影响。他们的工作指出,关闭LRRK2激酶结构域的激酶抑制剂可能会导致阻断分子马达运动的不良影响。
“目前还不清楚lrrk2 -微管结合在帕金森病中起什么作用,”加州大学圣地亚哥分校医学院和生物科学部教授、霍华德休斯医学研究所研究员雷克-彼得森说。“但我们现在拥有的是细胞和分子蓝图,这就是弄清LRRK2的作用和微调针对LRRK2的治疗药物所需要的。”
参考:
1)别墅等。帕金森病相关LRRK2的原位结构。细胞(2020)。DOI:https://doi.org/10.1016/j.cell.2020.08.004
本文已从以下地方重新发布材料.注:材料的长度和内容可能经过编辑。如需进一步信息,请联系所引用的来源。




